锂酰胺作为共轭加成α,β-不饱和酯的同型氨等价物:(S)-β的不对称合成:亮氨酸
 |
讨论
对映体纯锂N-苄基-N – (α-甲基苄基)酰胺与α,β-不饱和酯和酰胺的共轭加成显示出高的非对映选择性和极宽的底物范围,因此该方法被认为是最稳健可靠的方法之一制备β-氨基酸衍生物的方法。在大多数情况下,该过程的立体化学结果是可预测的,并且通过过渡态助记符合理化。2这种方法已经找到许多应用,包括在目标合成和分子识别phenomenα的区域,并在2005年进行了全面综述,3 2012,4和2017年5
氨基酰胺家族和选择性脱保护策略
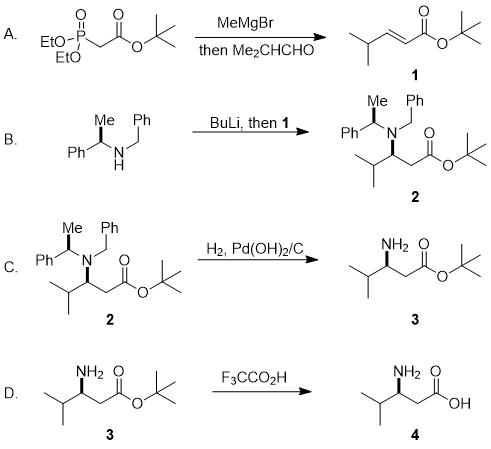
除了最常用的氨基化锂试剂,N-苄基-N-(α-甲基苄基)酰胺锂,还开发了20多种含有烯丙基,各种取代的苄基,卤代烷基和甲基杂芳基的类似物,用于共轭加成。还开发了分别作为手性“羟胺当量”和手性“苯胺当量”的对映体纯的锂酰胺18和21。氨基化锂家族的一些有代表性的成员的共轭加成在下面介绍和在共轭加成产物7,10,13,16,19和 22 分离为单一非对映异构体(方案1)。

方案1.代表性的氨基化锂的共轭加成[PMP = 4-甲氧基苯基; TDBMS = 叔丁基二甲基] 6,7,8,9,10,11
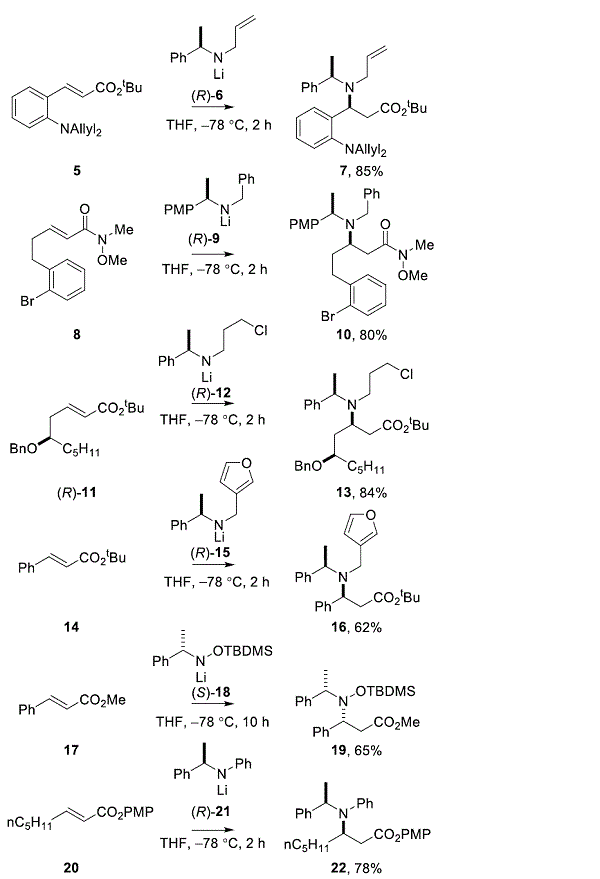
已经开发了几种用于去除N-保护基团的化学选择性去保护方法。例如,在室温下用MeCN / H 2 O中的硝酸铈铵(CAN)处理23小时12小时,得到选择性单脱苄基化的β-氨基酯24,产率为60%。13氧化除去的Ñ -3,4-二甲氧基苄基内25与2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ),得到26,收率98%。14的p -甲氧基变体,结合有Ñ -α甲基p – 甲氧基苄基,可在各种酸性条件下除去; 例如:用HCO 2 H和Et 3 SiH 处理10,得到27,产率81%。7处理28与Pd催化剂和Ñ,Ñ -dimethylbarbituric酸 29顺利除去Ñ -烯丙基基团,得到30在97%的产率(方案2)。15

方案2.代表性的化学选择性N-去保护[PMP = 4-甲氧基苯; TDBMS = 叔丁基二甲基甲硅烷基]
β-氨基酸衍生物的α-功能化
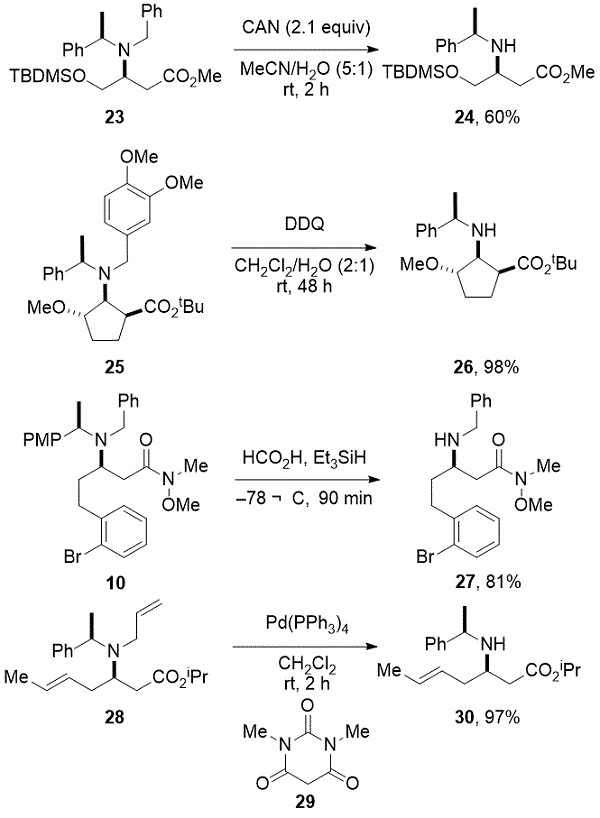
为了扩展可获得的β-氨基酸衍生物的结构多样性,已经研究了β-氨基酯的α-官能化。β-氨基酸衍生物的α-官能化可以通过制备中间烯醇化物来实现,所述中间体烯醇化物是通过将酰胺锂试剂与亲电子试剂(串联方式)共轭加成到α,β-不饱和酯上而得到的。或者,在用强碱(例如LDA,NaHMDS等)使β-氨基酯去质子化后形成相应的β-氨基烯醇化物,然后用亲电试剂处理(逐步方式)时,可以实现α-官能化。这些方法的立体化学结果和非对映选择性取决于底物和亲电子试剂的性质。16例如,在(S)-32和α,β-不饱和酯31反应之后“串联”共轭加成/烷基化,然后将烯丙基溴加成到中间体锂(Z)-β-氨基烯醇化物(Z)-33得到34,收率60%作为C的85:15混合物(2)差向异构体,17而治疗β氨基酯的35与LiTMP以形成相应的烯醇化物(ë) – 36在原位和除了丙烯醛37得到38以单一非对映异构体产物的96%收率(方案3)。18

方案3.“串联”和“逐步”α-官能化策略
通过将对映体纯的氨基化锂40与α,β-不饱和酯39以及各种亲电子试剂共轭加成而得到的β-氨基烯醇化物的处理有助于制备一系列α-氟,
α-巯基和α-羟基-β-氨基酸衍生物41。例如,Duggan及其同事报道了使用亲电氟化剂N-氟苯磺酰亚胺(NFSI)对α,β-不饱和酯进行串联共轭加成/氟化 ,得到77%的抗 α-氟-β-氨基酯42让。19类似地,抗 -α- 叔丁硫基-β氨基酯43通过用TsS t Bu 原位烯醇化物捕获,获得88%收率的单一非对映异构体。20原位烯醇化氧化与必需的坎帕西洛沙唑啶(CSO)对映已被公认为不对称抗氨基羟基化的有力工具,并且在文献中经常报道(过去5年中> 50个例子)。例如,通过将(R)-32与所需的α,β-不饱和酯共轭加成,然后用( – ) – CSO以80%的收率作为单一非对映异构体进行烯醇化物氧化,得到44(方案4)。21,22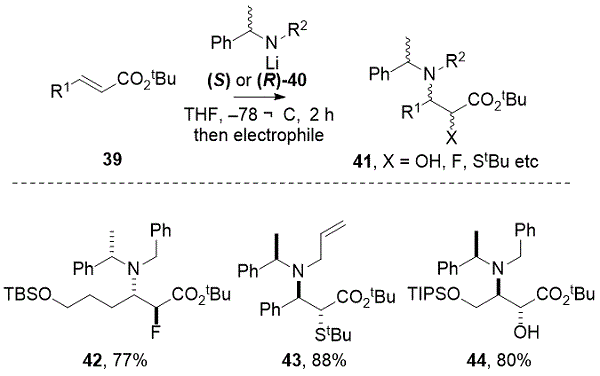
α-巯基和α-羟基-β-氨基酸衍生物41。例如,Duggan及其同事报道了使用亲电氟化剂N-氟苯磺酰亚胺(NFSI)对α,β-不饱和酯进行串联共轭加成/氟化 ,得到77%的抗 α-氟-β-氨基酯42让。19类似地,抗 -α- 叔丁硫基-β氨基酯43通过用TsS t Bu 原位烯醇化物捕获,获得88%收率的单一非对映异构体。20原位烯醇化氧化与必需的坎帕西洛沙唑啶(CSO)对映已被公认为不对称抗氨基羟基化的有力工具,并且在文献中经常报道(过去5年中> 50个例子)。例如,通过将(R)-32与所需的α,β-不饱和酯共轭加成,然后用( – ) – CSO以80%的收率作为单一非对映异构体进行烯醇化物氧化,得到44(方案4)。21,22

方案4.β-氨基烯醇化物的α-官能化
相应的顺式 -α-羟基-β-氨基酯47可通过氧化/非对映选择性还原方案制备。23例如,Swern氧化的抗 -α羟基-β氨基酯45,得到相应的酮46,和还原或者加入NaBH 4在MeOH或DIBAL-H在THF通常给出的> 90:10混合物顺式 – 47和抗 – 45,分别与相应的顺式 -α羟基-β氨基酯 47可以被分离为单个对映异构体。代表性的最近实例如下所示(方案5)。22, 24,25
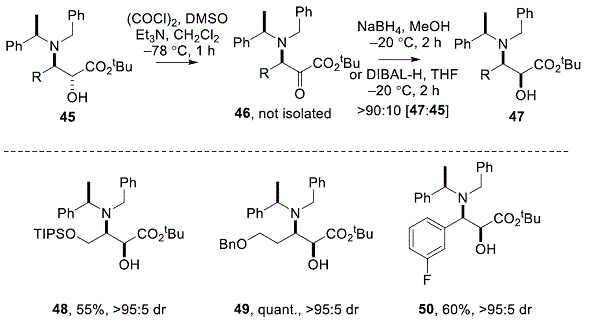

方案5. 合成 -β-氨基-α-羟基酯的制备
环状β-氨基酸合成
通过将N-烯丙基-N-(α-甲基苄基)酰胺锂或N-丁-3-烯基-N-(α-甲基苄基)酰胺锂共轭加成合适的α,制备了对映纯的环状β-氨基酸制剂。,β-不饱和酯,其次是闭环复分解作为关键步骤。例如,将(S)-N-烯丙基-N-(α-甲基苄基)酰胺(S)-6与α,β-不饱和酯 51(衍生自山梨酸)的共轭加成在78中得到β-氨基酯52% 让。用Grubbs I催化剂闭环复分解52,得到环状β-氨基酯53%收益率为77%。在Wilkinson催化剂存在下逐步氢化 53并随后氢解除去N-保护基团,得到氨基酯 55,产率79%(来自53)。酸介导的酯水解得到(S) – 高脯氨酸56,收率96%(方案6)。26该方法的应用,包括将含有链烯基官能团的对映体纯化的氨基化锂与所需的α,β-不饱和酯共轭加成,然后进行闭环复分解,为各种氮杂环支架如环状β-氨基提供关键中间体。氨基酸57 – 59,吡咯烷,27个哌啶,28,29,30和吡咯烷并。17,31,32
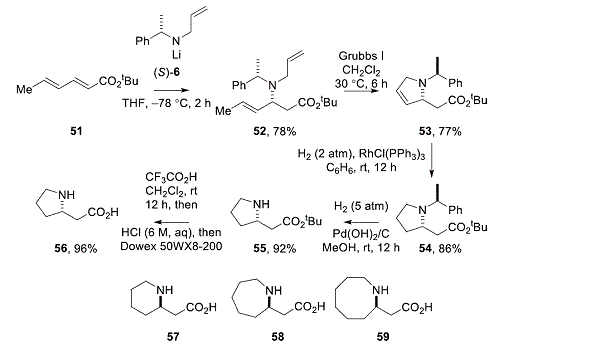

方案6.环状β-氨基酸的制备
重排向α-氨基酸
通过α,β-不饱和酯的氨基羟基化和通过相应的氮丙啶鎓离子中间体的立体特异性重排,也已经开发了获得天然和非天然α-氨基酸衍生物的合成途径。24,25例如,氨羟化 1与([R )- 32和( – ) – CSO,得到抗 -α羟基-β氨基酯60在56%的产率和> 99:1个博士。用Tf 2 O和DTBMP 61处理60可以在60内以三氟甲磺酸酯的形式活化羟基,然后形成相应的氮丙啶鎓离子中间体62在被相邻的叔氨基置换后。随后用H 2 O 区域选择性地开环62,得到β-羟基-α-氨基酯63,产率68%,纯化后> 99:1 dr。在Pd催化剂存在下通过氢解脱保护63,然后进行酸介导的水解,得到(S,S)-β-羟基亮氨酸64,产率69%,两步≥96:4(方案7)。33这种重排通过吖丙啶鎓离子中间前进使用其它亲核试剂(如氟离子和叠氮化物)允许访问各种β-α官能氨基酸衍生物在高非对映异构纯度。34
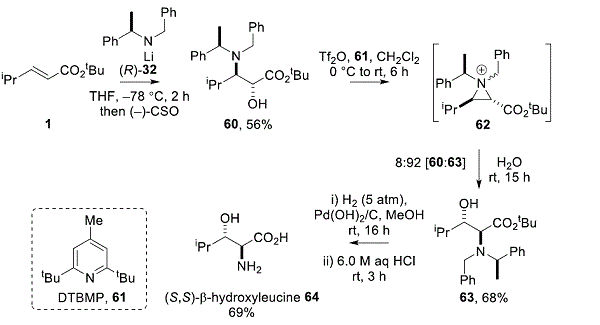

方案7. 通过氮丙啶重排的α-氨基酸合成
总之,对映体纯的锂酰胺与α,β-不饱和羰基化合物的共轭加成已经在高化学产率和优异的非对映选择性方面得到了广泛的基质范围的证明。在过去的几年中,已经实现了对所得β-氨基酯产物或β-氨基烯醇化物的精制开发,这不仅将继续有助于氨基酸/肽化学领域,而且还将在天然产物领域中不断发挥作用。和药学上重要的靶标合成。
参考和说明







