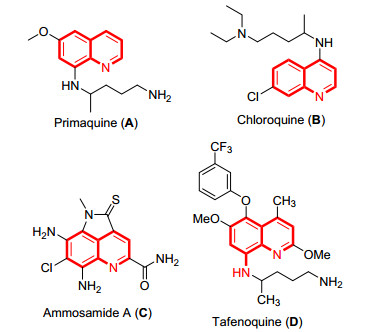
 图 1 氨基喹啉类药物 Figure 1. Selected examples for aminoquinolines bioactive molecules
图 1 氨基喹啉类药物 Figure 1. Selected examples for aminoquinolines bioactive molecules 氨基喹啉(Aminoquinoline, AQ)及其衍生物是一种在天然产物和药物分子中存在的重要芳香含氮杂环, 大多数以生物碱的形式存在.氨基喹啉在药物中有着重要的应用[1], 也能在材料领域用于金属离子吸附和荧光成像[2].相比其它的喹啉衍生物, 氨基喹啉具有高效的生物活性.比如伯氨喹、氯喹啉以及他非诺喹等具有疟疾预防和治疗作用(图 1).他非诺喹是一种对8-氨基喹啉C(5) 位进行修饰后得到的新型药物, 与扑疟喹和伯氨喹相比, 具有较小的毒性; 其在血液代谢中周期更长, 该药物和其它喹啉类药物合用可根治间日疟原虫引起的疟疾[3].
 图 1 氨基喹啉类药物 Figure 1. Selected examples for aminoquinolines bioactive molecules
图 1 氨基喹啉类药物 Figure 1. Selected examples for aminoquinolines bioactive molecules
8-氨基喹啉还可作为有机配体或双齿导向基参与一系列有机合成反应. 2005年, Daugulis小组[4]首次报道了8-氨基喹啉衍生物作为双齿导向基的γ位C(sp3)—H键芳基化反应.随着这一体系的逐渐完善, 已有许多优秀的课题组报道了8-氨基喹啉在双齿导向基方面的应用(图 2)[5].基于对碳-氢活化领域的持续兴趣[6], 最近我们[7]也报道了一些8-氨基喹啉导向的碳氢键功能化的工作.
 图 2 8-氨基喹啉作为导向基团在碳氢活化方面的应用 Figure 2. 8-Aminoquinoline as derecting group in C—H activation
图 2 8-氨基喹啉作为导向基团在碳氢活化方面的应用 Figure 2. 8-Aminoquinoline as derecting group in C—H activation
在喹啉母环上连接上不同化学性质的取代基(如吸电子基团、给电子基团或大位阻基团), 能显著改变喹啉的物理化学性质, 因而具有潜在的应用价值.目前已有许多经典的缩合反应, 如Skraup, Döbner-Von Miller, Friedländer, Conrad-Limpach-Knorr和Combes synthesis反应可用于高效合成单取代或多取代喹啉衍生物[8].但是上述反应存在着需要强酸、高温的条件等缺点, 从而限制了其底物适应范围; 并且当环化的取代基不同时, 存在着选择性难以控制等难题.
近年来, 因不需要对底物进行预官能化变成有机金属试剂或者有机卤化物, 具有原子经济性和步骤经济性等优点, 碳氢活化取得了广泛的进展[9, 5h].现已发展成为构建C—C键和C—Z (Z为杂原子)键的重要方法之一.氢/氘交换研究表明在强酸性介质中喹啉环各位置亲电取代反应的顺序为8>5, 6>7>3, 吡啶环相邻的位置(5和8) 是活性最高的.它的亲电取代反应大多仅发生在苯环, 而亲核取代反应几乎在吡啶环上发生[10].
通过对现有氨基喹啉母体结构进行碳氢键活化/官能团化来构建单取代及多取代喹啉无疑是方便快捷的一种方法.已有一系列合成方法见诸报道, 如许多课题组报道了喹啉C(2)[11], C(3)[12], C(4)[13]和C(8)[14]位活化的例子; 也有一些综述被报道出来[15]. 2015年, Sawamura等[15a]系统总结了过渡金属催化的喹啉环位置[C(2) 除外]选择性活化的报道.同年, Larionov等[15b]总结了最近十年吡啶及喹啉吡啶A环的位置选择性研究进展.但是, 专一地对于喹啉环5位碳氢键官能化的研究进展, 目前还没有报道.基于此, 本综述从近年来8-氨基喹啉5位碳氢键官能化的研究工作出发, 系统总结合成方法中的反应条件、底物适用范围和反应机理的异同点, 为喹啉5位的进一步研究及喹啉其它位置的研究提供参考.
化学慧定制合成事业部摘录







