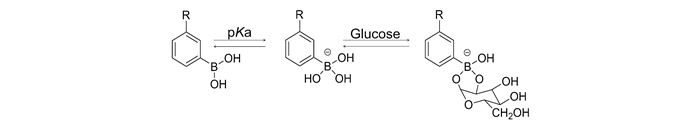
 图 1 PBA与葡萄糖的相互作用示意图[22] Figure 1. Schematic interaction between PBA and glucose[22]
图 1 PBA与葡萄糖的相互作用示意图[22] Figure 1. Schematic interaction between PBA and glucose[22] 糖尿病是一种以长期慢性高血糖为特征的代谢性疾病,这种疾病因胰岛素分泌异常和(或)胰岛素抵抗而引起糖类、蛋白质和脂肪等代谢异常,久病可导致血管、心脏、神经、肾脏、眼等组织器官的慢性并发症,严重威胁着人类的健康。随着生活水平的提高、人口老龄化与生活方式的改变,糖尿病患病率逐年上升,成为继心血管疾病和癌症之后排名第三的人类健康杀手,带给社会和家庭沉重的负担。数据表明,截止至2013年,全球糖尿病患者数已达3.82亿,预计2035年全球糖尿病患者数将达到5.92亿[1–3]。因此,糖尿病防治已经成为一个亟待解决的医学和社会问题。原发性糖尿病分为1型糖尿病和2型糖尿病两种。其中1型糖尿病是由淋巴细胞介导的、以免疫性胰岛炎和选择性胰岛β细胞损伤为特征的自身免疫性疾病,约占糖尿病患者总数的5%~10%。2型糖尿病是由胰岛β细胞分泌功能缺陷和(或)胰岛素抵抗导致的胰岛素相对不足而血糖升高的症状,约占糖尿病总人数的90%[4]。
目前,补充外源性胰岛素是治疗糖尿病最直接最有效的方法[5]。除常规注射给药外,鼻腔给药、超声介导给药甚至是皮下包埋等非注射胰岛素给药途径逐渐受到青睐。但由于胰岛素是蛋白类药物,其相对分子质量大、半衰期短、易变性以及脂溶性差,导致非注射给药时生物利用度很低,并且受制药技术的制约,这些非注射给药途径仍处于实验研究阶段[6–10]。在各种给药途径中,口服胰岛素因其给药方便且具有与内源性胰岛素相同的递送机制而被认为是最合理的给药途径[11]。然而,实现口服胰岛素给药仍然存在两个主要问题:一方面,胰岛素在胃肠道强酸环境中易降解,胃肠道中pH梯度较大且存在许多水解蛋白酶,易使胰岛素失活;另一方面,胰岛素在小肠中不易被吸收,由于肠上皮和粘液层抑制大分子的运输,导致胰岛素不易渗透入血[12–13]。这些缺点限制了口服胰岛素的临床应用。皮下注射胰岛素给药仍是治疗糖尿病的常规途径。虽然皮下注射胰岛素能够快速降低血糖,但每日数次的注射带给患者极大的身体和精神痛苦,长期使用病人的耐受性和依从性较差。故此,研究人员开始更多的关注可减少给药次数的新型给药方式。
从1954年Kuivila等[14]发现苯硼酸(PBA)与二元醇特异性结合这一特性开始,关于葡萄糖敏感PBA基高分子载药材料的研究就从未停止。葡萄糖敏感药物传递系统能够模拟人体胰腺分泌胰岛素的生理模式,根据血糖浓度的变化控制胰岛素释放并调控血糖水平,具有“人工胰腺”之称。基于PBA的葡萄糖敏感高分子材料近年来备受关注,这是一种全合成的体系,具有体系稳定、长期保存的特点,用于药物的自调式控制释放更具有可逆葡萄糖响应性的优势[15–16]。
PBA是一种路易斯酸,在药物传递领域具有广泛的应用[17–20]。PBA的pKa值的范围在8.2~8.6[21]。在水溶液中,PBA有未电离的平面三角形的疏水形式和电离的立体正四面体的亲水形式两种存在方式,且这两种形式间存在可逆的动态平衡[22–23]。这两种形式均能够与1, 2-二元醇或多元醇(葡萄糖等)特异性结合形成五元或六元环的苯硼酸酯复合物。但电离形式的PBA与葡萄糖形成的苯硼酸酯亲水性更好,结构更加稳定(图 1)。当溶液pH值大于PBA的pKa时,PBA主要以带电的相对亲水的构型存在。此时,PBA功能化的载体与葡萄糖特异性结合后可形成亲水性较强的苯硼酸酯,使得PBA的电离平衡正向移动,增加了电离形式PBA的比例。这种电离平衡正向移动提高了PBA功能化载体材料的亲水性,且PBA由平面三角形转化为立体的正四面体结构增大了载体材料的空间体积。两种作用均使得药物载体响应葡萄糖浓度的变化而将所担载的药物释放出来,且葡萄糖浓度越大药物释放速度越快,释放总量越大。除此之外,采用特殊的结构设计,PBA功能化的药物载体在葡萄糖存在下也会因收缩而将药物释放出来[24]。这种与二元醇特异性结合的特性使PBA功能化的载体拥有良好的葡萄糖敏感性能,使得PBA及其衍生物在葡萄糖敏感药物传递系统中具有极大的应用潜力[25–28]。经过不断的努力,PBA基葡萄糖敏感的水凝胶、微凝胶、纳米载体等均取得较大的进展[29–32]。但PBA基纳米载体因其较长的血液循环时间和高载药量等受到研究者更广泛的关注[33–34]。
 图 1 PBA与葡萄糖的相互作用示意图[22] Figure 1. Schematic interaction between PBA and glucose[22]
图 1 PBA与葡萄糖的相互作用示意图[22] Figure 1. Schematic interaction between PBA and glucose[22]
尽管如此,将PBA及其衍生物应用于糖尿病治疗的葡萄糖敏感药物传输体系还面临许多困难,诸如葡萄糖响应的pH高于生理pH和葡萄糖响应浓度远高于糖尿病患者的血糖水平[35]。因此,研究者们将具有环境敏感性能的单体或聚合物接枝或共聚到PBA及其衍生物体系中而得到纳米载体,并通过这些功能化的基团感应外界环境因素的变化来控制药物释放速率。按照响应因素不同,可将PBA基葡萄糖敏感纳米药物载体分为pH响应、温度响应、光响应等类型。本文重点介绍基于PBA的葡萄糖敏感高分子纳米药物载体的发展过程和应用,并对该领域的发展前景进行展望。
1 葡萄糖敏感PBA基高分子纳米药物载体
1.1 pH响应型PBA基葡萄糖敏感纳米药物载体
PBA基葡萄糖敏感药物载体应用于糖尿病治疗的前提是降低其pKa值,以实现生理pH下的葡萄糖敏感性能[36]。通过在PBA上引入羧基[21, 37]、氨基或硝基[29, 38]等基团可以降低PBA的pKa值,得到生理pH下具有较好葡萄糖敏感药物释放性能的高分子纳米载体。
本课题组通过开环聚合并经过PBA修饰得到聚乙二醇单甲醚-block-聚(L-谷氨酸-co-谷氨酰胺基苯硼酸)(mPEG-b-P(GA-co-GPBA))嵌段共聚物,该嵌段共聚物可自组装成纳米胶束[39]。此胶束在生理pH下可依据葡萄糖浓度的变化而控制胰岛素的释放,呈现出“开-关”式释放的特性。
Yang等[40]采用原子转移自由基聚合(ATRP)方法,以单甲氧基聚乙二醇-溴(mPEG5000-Br)为引发剂,引发自制单体(2-苯硼酸酯-1, 3-二噁烷-5-乙基)丙烯酸甲基酯(PBDEMA)聚合,制备了嵌段共聚物mPEG5000–b-PPBDEMA。该共聚物自组装成的纳米胶束在遇到葡萄糖分子时,胶束内核处苯硼酸酯基团的断裂增加了胶束的亲水性和体积,甚至可使胶束解体。这种胶束在pH=7.4时短时间内即可展现出良好的葡萄糖响应性并快速释放药物,且药物释放具有“开-关”式的特性。
同样采用ATRP聚合方法,Shi课题组[37]用引发剂PEG-Br引发丙烯酸叔丁酯聚合并经过功能化修饰,得到聚(乙二醇)-block-聚(丙烯酸-co-丙烯酰胺基苯硼酸)(PEG-b-P(AA-co-AAPBA))嵌段共聚物。该嵌段共聚物可自组装成“核-壳”结构的纳米胶束,且胶束以P(AA-co-AAPBA)为内核,以PEG为外壳。羧基和硼原子的配位作用可降低PBA的pKa。当PBA的修饰率为63%时,纳米胶束在生理pH值条件下具有良好的葡萄糖敏感药物释放性能。在此基础上,该课题组还进行了更深入的研究,制备了可增强葡萄糖敏感性能的苯硼酸-糖聚物纳米复合胶束[41–42](图 2)。通过聚丙烯酸(PAA)接枝2-氨基葡萄糖(AGA)得到糖基化聚合物P(AA-co-AGA)。将上述糖基化聚合物与PEG-b-P(AA-co-AAPBA)复合,最终得到内核为P(AA-co-APBA)/P(AA-co-AGA)、外壳为PEG的复合纳米胶束。和单一胶束相比,该复合纳米胶束的稳定性和生物相容性更好,为葡萄糖敏感聚合物的构筑提供了一种新的思路。
 图 2 P(AA-co-APBA)/P(AA-co-AGA)复合微凝胶粒的形成和葡萄糖响应性崩解示意图(A)。在pH=7.4,葡萄糖浓度=2 g/L的PBS中,不同比例PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w)复合胶束的葡萄糖响应性(B)[41] Figure 2. Schematic illustration for formation and glucose-disintegration of PEG-b-P(AA-co-APBA)/P(AA-co-AGA) complex micelle(A). Glucose-responsiveness of PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w) micelle in aqueous solution of PBS at 7.4 with the concentration of glucose is 2 g/L(B)[41]
图 2 P(AA-co-APBA)/P(AA-co-AGA)复合微凝胶粒的形成和葡萄糖响应性崩解示意图(A)。在pH=7.4,葡萄糖浓度=2 g/L的PBS中,不同比例PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w)复合胶束的葡萄糖响应性(B)[41] Figure 2. Schematic illustration for formation and glucose-disintegration of PEG-b-P(AA-co-APBA)/P(AA-co-AGA) complex micelle(A). Glucose-responsiveness of PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w) micelle in aqueous solution of PBS at 7.4 with the concentration of glucose is 2 g/L(B)[41]
除了ATRP聚合方法之外,采用可逆加成-断裂转移自由基聚合(RAFT)也是制备葡萄糖敏感嵌段共聚物的有效方法[43–46]。通过RAFT聚合方法,Kim等[47]得到可自组装成纳米囊泡的嵌段共聚物聚苯乙烯硼氧烷(PEG-b-PBOx)。在生理pH条件下,组成囊泡的PBA基团与单糖相互作用,使囊泡解体并释放出被标记的胰岛素。而在没有单糖和(或)1<pH<7时,则无胰岛素释放。这种PBA共聚物自组装的纳米囊泡载药率较高,在药物传递领域具有很好的应用前景。
近年来,介孔二氧化硅(MSN)在组织工程和药物传递领域备受青睐[48–49]。MSN具有极好的生物相容性和可调的介孔尺寸,且孔隙率较大,可修饰性较强。许多研究者将PBA功能化的MSN用于葡萄糖敏感药物传输体系,可获得具有较好药物缓释特性的纳米杂化粒子[50–51]。
Liu等[52]采用MSN设计了新型的葡萄糖和pH双敏感聚合物包覆杂化纳米颗粒(图 3)。MSN上的聚合物刷是EPBA交联的P(AA-AGA)。该聚合物刷包覆在MSN的表面起到“盖子”的作用,并将模型药物Rhodamine 6G(Rd6G)包埋在MSN内部的空隙中。在葡萄糖溶液中,葡萄糖分子可取代聚合物上的糖基元竞争性与PBA结合,而这种竞争性结合可以掀开MSN的“盖子”,使包埋在MSN中的药物释放出来。在pH值低于EPBA的pKa的酸性溶液中,EPBA与聚合物刷上糖基元的特异性结合会受到破坏,所以该MSN的药物释放行为还受溶液pH值的影响。在葡萄糖浓度相同的情况下,Rd6G的释放速率随着溶液pH的降低而加快。
 图 3 在pH=7.4的PBS溶液中,不同葡萄糖浓度下MSN-PAA-AGA粒子释放Rd6G的总量[52] Figure 3. Cumulative release of Rd6G from MSN-PAA-AGA in PBS(pH=7.4) with different concentrations of glucose[52]
图 3 在pH=7.4的PBS溶液中,不同葡萄糖浓度下MSN-PAA-AGA粒子释放Rd6G的总量[52] Figure 3. Cumulative release of Rd6G from MSN-PAA-AGA in PBS(pH=7.4) with different concentrations of glucose[52]
1.2 温度响应型PBA基葡萄糖敏感纳米药物载体
为了在人体生理温度条件下得到合适的PBA衍生物用于葡萄糖敏感药物传输载体,科研工作者进行了大量的研究。
采用开环聚合方式,Shi等[53]利用聚异丙基丙烯酰胺(PNIPAM)的温度响应特性,制备了聚乙二醇-block-聚(天冬氨酸-co-天冬酰胺基苯硼酸)(PEG-b-P(Asp-co-AspPBA))和聚异丙基丙烯酰胺-block-聚(天冬氨酸-co-天冬酰胺基苯硼酸)(PNIPAM-b-P(Asp-co-AspPBA))嵌段共聚物。这两种共聚物可自组装成纳米复合胶束(图 4)。这种纳米复合胶束的内核由疏水的P(Asp-co-AspPBA)组成,而外壳则由PEG/PNIPAM复合而成,形成经典的“核-壳”结构。在温度37 ℃时,温敏性的PNIPAM层塌缩在胶束内核的表面并形成一层连续的膜结构。在聚合物胶束内核和PNIPAM膜层中间则是PEG层,复合胶束由经典的“核-壳”结构转变为特殊的“核-壳-冠”结构(图 4)。该复合胶束结构稳定,可表现出可逆的葡萄糖响应性溶胀行为,更重要的是具有反复“开-关”式释放胰岛素的特性。此外,连续的PNIPAM膜能够保护包载的药物免受酶的降解而保持原有的生物活性。在此基础上,该课题组[54]还利用环糊精主客体相互作用的特性制备了葡萄糖敏感的聚合物囊泡来提高载药率。首先制备了含葡萄糖胺的共聚物聚(乙二醇)-block-聚(天冬氨酸-co-天冬酰胺基葡萄糖)(PEG45–b-P(Asp-co-AspGA)),然后通过加入α-环糊精(α-CD)利用主-客体相互作用形成具有“核-壳-冠”结构的PEG45–b-P(Asp-co-AspGA)胶束。当移除α-CD后,得到内、外层均由PEG组成、而中间层为P(Asp-co-AspGA)/P(Asp-co-AspPBA)的纳米囊泡,囊泡壳层中天冬酰胺基葡萄糖的GA和PBA可特异性结合形成苯硼酸酯并增强壳层的稳定性。该囊泡具有较好的葡萄糖敏感性能。除此之外,该课题组[55]将PEG45–b-P(Asp-co-AspGA)加入到热敏感聚合物胶束PNIPAM-b-P(Asp-co-AspPBA)中得到“核-壳-冠”结构的纳米复合胶束。“核-壳-冠”结构的纳米复合胶束在低于PNIPAM的最低共溶温度(LCST)时则形成聚合物囊泡。该聚合物囊泡具有膨胀的PNIPAM内层、交联的P(Asp-co-AspGA)/P(Asp-co-AspPBA)膜以及PEG冠层结构。利用PNIPAM的温敏性制备具有特殊结构的葡萄糖敏感纳米载体材料可自调式“开-关”控制胰岛素释放,并保护药物免受酶的降解,在糖尿病治疗方面具有较大的潜在应用价值。
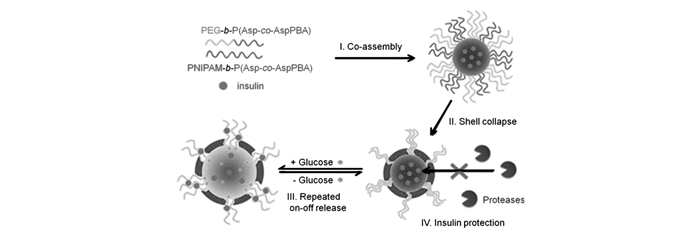 图 4 葡萄糖敏感复合聚合物胶束用于生理条件下可重复“开-关”胰岛素释放和胰岛素保护[53] Figure 4. Schematic illustration of glucose-responsive complex polymeric micelle(CPM) for repeated “on-off” release and insulin protection under physiological conditions[53]
图 4 葡萄糖敏感复合聚合物胶束用于生理条件下可重复“开-关”胰岛素释放和胰岛素保护[53] Figure 4. Schematic illustration of glucose-responsive complex polymeric micelle(CPM) for repeated “on-off” release and insulin protection under physiological conditions[53]
1.3 光响应型PBA基葡萄糖敏感纳米药物载体
光响应型药物释放体系具有较好的潜在应用前景,利用特定波长的光线作为刺激因素,引起聚合物载体响应性释放药物,成为一个有发展前景的研究方向[56]。光刺激是一种洁净、无创、高效的刺激类型,光响应型高分子载体用于药物的传递具有时间和空间上可控性,光疗法也逐渐兴起。以硝基苯衍生物为代表的光致断裂型PBA功能化高分子材料也可用于葡萄糖敏感药物释放体系。Jiang课题组[57]通过实验设计,采用RAFT聚合方法以聚(甲氧基聚乙二醇丙烯酰胺)(MePEGA)为引发剂,引发AAPBA和邻硝基苄基丙烯酸酯(NBA)共聚,制备了MePEGA-b-(PNBA-co-PAAPBA)嵌段共聚物,该嵌段共聚物能够自组装成具有光-葡萄糖双敏感的纳米胶束。研究表明,在可见光照射下,30 min内胰岛素的累积释放量仅为20%,而在紫外光(λmax=365 nm,75 mW/cm2)照射下,30 min内胰岛素的释放总量则高达98%。紫外光促使药物的快速释放是由于在紫外光照射下,疏水的PNBA可转变成亲水性的PAA,聚合物的亲疏水平衡发生向亲水性方向的移动,从而使聚合物胶束的亲水性增加并伴有胰岛素的快速释放。该聚合物也具有葡萄糖响应性胰岛素的可控释放性能。基于PBA与多元醇的特异性结合,在葡萄糖浓度为25 mmol/L的溶液中,胰岛素的累积释放量是不含葡萄糖的溶液中的18倍。这种紫外光和葡萄糖双敏感的聚合物在自调式药物控制释放体系中具有极其重要的应用。
2 PBA基葡萄糖敏感纳米药物载体的生物应用研究
除了良好的环境响应性药物释放性能外,材料的毒性及生物相容性是评价新型载体材料的另一个关键因素。生物相容性是生命体组织对非活性材料产生各种复杂的生物、物理、化学反应的一种性能,以及对这些反应的忍受程度[58]。良好的生物相容性是葡萄糖敏感药物载体材料应用于胰岛素自调式药物传递系统的必要条件。
多聚糖及糖类聚合物具有较好的生物相容性和生物降解性,被广泛应用于药物传递系统[59]。采用RAFT聚合方法,Zhang等[60]制备了含糖共聚物聚丙烯酰胺基苯硼酸-block-聚(甲基丙烯酸2-(N-葡萄糖酰胺)乙酯)(P(AAPBA-b-GAMA))。聚合物上的PBA基团与类糖聚合物上的二羟基特异性结合,使共聚物自组装成具有亲水性的PGAMA冠和疏水的PAA-PBA核的交联纳米粒子(图 5)。当葡萄糖分子存在时,游离的葡萄糖小分子将和类糖聚合物竞争性与PBA结合,从而使聚合物纳米粒子疏松甚至解体。这种竞争性结合机制使得该交联纳米粒子具有良好的葡萄糖敏感性能。而GAMA作为一种可再生糖不仅可以降低共聚物的pKa,还可以降低生物毒性,提高共聚物的生物相容性[61]。这种葡萄糖敏感药物控制释放行为是可逆的,用于胰岛素的担载,纳米载体可依据血糖变换调控胰岛素的释放并控制血糖稳定减少血糖波动。这类智能药物输送系统在糖尿病治疗中具有较大的应用潜力。
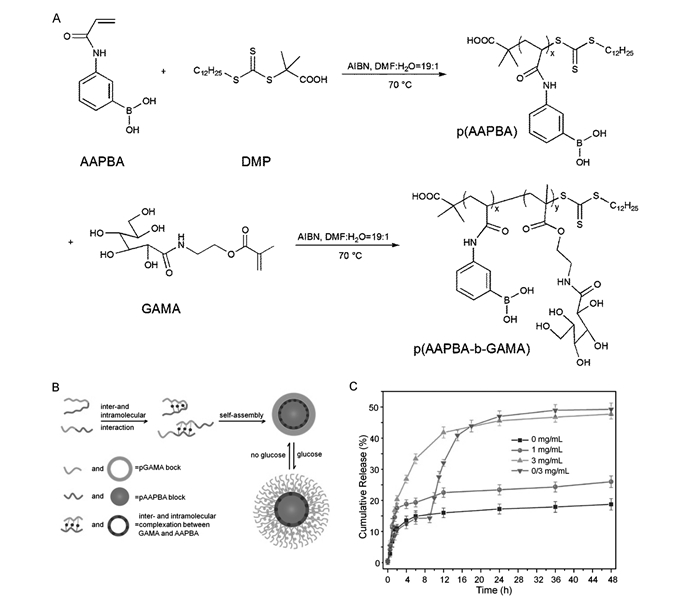 图 5 P(AAPBA-b-GAMA)嵌段共聚物的合成(A),P(AAPBA-b-GAMA)纳米粒子示意图(B)和pH=7.4的PBS中葡萄糖响应纳米粒子的胰岛素释放曲线(C)[60] Figure 5. Synthesis of P(AAPBA-b-GAMA) block polymer(A), schematic representation for formation of P(AAPBA-b-GAMA) nanoparticle(B), and cumulative release of insulin in pH=7.4 PBS from nanoparticle triggered by glucose(C)[60]
图 5 P(AAPBA-b-GAMA)嵌段共聚物的合成(A),P(AAPBA-b-GAMA)纳米粒子示意图(B)和pH=7.4的PBS中葡萄糖响应纳米粒子的胰岛素释放曲线(C)[60] Figure 5. Synthesis of P(AAPBA-b-GAMA) block polymer(A), schematic representation for formation of P(AAPBA-b-GAMA) nanoparticle(B), and cumulative release of insulin in pH=7.4 PBS from nanoparticle triggered by glucose(C)[60]
采用同样的竞争性结合机制,Cheng等[62]报道了一种通过RAFT聚合得到的新型两亲性嵌段共聚物聚(甲基丙烯酸2-(N-乳糖酰胺)乙酯)-block-聚(3-丙烯酰胺基苯硼酸)(P(LAMA-b-AAPBA))。该两亲性嵌段共聚物能够自组装成较小尺寸的纳米球,纳米球的平均粒径为238~403 nm。该纳米球应用于胰岛素的担载能够响应葡萄糖的刺激而快速释放出药物。此外,纳米球中含糖聚合物与苯硼酸基团的结合不仅降低了苯硼酸的细胞毒性,还能够促进细胞增殖,赋予纳米球较好的生物相容性。该纳米球具有较好的葡萄糖敏感药物传递应用前景。
同样利用含糖聚合物降低PBA的毒性,Li课题组[63]成功制备了PBA功能化的含糖聚合物聚(丙烯酸-co-丙烯酰胺基苯硼酸)-block-聚(2-丙烯酰基氧乙基半乳糖)(PAA-co-PAAPBA)-b-)2PAEG),该共聚物可自组装成纳米胶束。含糖聚合物的存在既可降低PBA的毒性,又赋予纳米粒子良好的生物相容性。良好的pH和葡萄糖双敏感性能使该纳米胶束具有较好的应用前景。
含糖聚合物的加入提高了PBA基葡萄糖敏感聚合物材料的生物相容性和生物降解性,增大了其临床应用的潜力。Wu等[64]设计了一种可注射的纳米凝胶(P(NIPAM-Dex-PBA))。该纳米凝胶由PNIPAM和AAPBA组成,并采用葡聚糖-马来酸酐(Dex-Ma)进行交联。用于胰岛素的担载,该纳米凝胶可响应葡萄糖的刺激而释放出胰岛素,且纳米凝胶中葡聚糖的含量越高葡萄糖敏感性能越好(图 6A)。将可注射纳米凝胶用于动物实验,在糖尿病大鼠体内,该纳米凝胶具有良好的降血糖效果。如图 6B所示,载药MG3纳米凝胶具有较好的降血糖效果,且能够保持血糖水平稳定避免血糖的波动。该可注射纳米凝胶推动了葡萄糖敏感胰岛素自调式药物传递系统的发展。
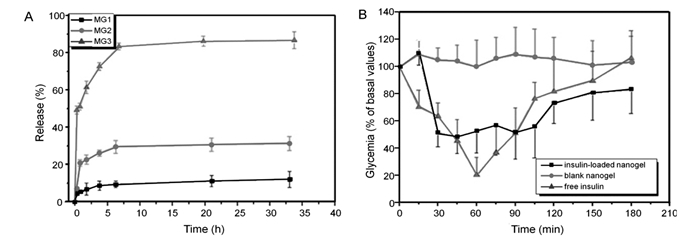 图 6 在pH=7.4、0.1 mol/L的PBS中(含2.0 mg/mL葡萄糖)的纳米凝胶控制释放胰岛素的曲线(MG1、MG2和MG3为葡聚糖的含量增加的纳米凝胶)(A)和经皮下注射胰岛素(2.0 IU/kg)、载胰岛素MG3纳米凝胶(4.0 IU/kg)和空白MG3纳米凝胶处理后糖尿病大鼠的降血糖效果(B)[64] Figure 6. In vitro release of insulin from MG1, MG2, and MG3 nanogels in 0.1 mol/L PBS at pH=7.4 with 2.0 mg/mL of glucose(MG1, MG2, and MG3 stand for P(NIPAM-Dex-PBA) nanogels with different dextran contents, and the dextran contents are MG3 > MG2 > MG1(A), and profiles of glycaemia after a subcutaneous administration of free insulin(2.0 IU/kg), insulin-loaded MG3 nanogel(4.0 IU/kg), and blank MG3 nanogel in fed diabetic rats(B)[64]
图 6 在pH=7.4、0.1 mol/L的PBS中(含2.0 mg/mL葡萄糖)的纳米凝胶控制释放胰岛素的曲线(MG1、MG2和MG3为葡聚糖的含量增加的纳米凝胶)(A)和经皮下注射胰岛素(2.0 IU/kg)、载胰岛素MG3纳米凝胶(4.0 IU/kg)和空白MG3纳米凝胶处理后糖尿病大鼠的降血糖效果(B)[64] Figure 6. In vitro release of insulin from MG1, MG2, and MG3 nanogels in 0.1 mol/L PBS at pH=7.4 with 2.0 mg/mL of glucose(MG1, MG2, and MG3 stand for P(NIPAM-Dex-PBA) nanogels with different dextran contents, and the dextran contents are MG3 > MG2 > MG1(A), and profiles of glycaemia after a subcutaneous administration of free insulin(2.0 IU/kg), insulin-loaded MG3 nanogel(4.0 IU/kg), and blank MG3 nanogel in fed diabetic rats(B)[64]
同样利用糖类高分子材料,Kim等[65]设计了一种新型的聚氨基酸双层纳米凝胶。该课题组首先制备了海藻酸钠接枝的聚(L-谷氨酸-co–N-3-L-谷氨酰胺基苯硼酸)(SA-PGGA),然后结合改性的壳聚糖(GC)制备了GC/SA-PGGA双层纳米凝胶。在葡萄糖溶液中,葡萄糖小分子取代壳聚糖上的糖基元与PBA竞争性结合生成苯硼酸酯,增加了纳米凝胶的亲水性并促使其释放胰岛素,且葡萄糖浓度越大胰岛素的释放速度越快。该课题组还进行了糖尿病小鼠的动物实验,证实了该纳米凝胶良好的降血糖效果。该GC/SA-PGGA双层纳米凝胶具有葡萄糖响应的胰岛素自调式释放特性,有望应用于糖尿病的治疗。
除了含糖聚合物类材料,研究还发现,聚氨基酸材料也具有良好的生物相容性和生物降解性,用于葡萄糖敏感的高分子纳米材料可被广泛应用于糖尿病药物传递等生物医学领域[66–68]。本课题组利用聚氨基酸的这一特性,设计了聚乙二醇单甲醚-block-聚(γ-苯甲基-L-谷氨酸酯-co-糖基化-L-谷氨酸酯)(mPEG-b-P(BLG-co-(PLG-g-Glu)))纳米凝胶[69]。由于葡萄糖分子竞争性与PBA基团结合,使得纳米凝胶具有良好的葡萄糖响应性,该纳米凝胶可葡萄糖依赖性释放出所担载的胰岛素。细胞毒性实验及细胞溶血实验证明了该纳米凝胶良好的生物相容性。这类聚氨基酸葡萄糖敏感纳米凝胶在糖尿病的治疗方面具有一定的临床应用价值。
3 总结与展望
葡萄糖敏感苯硼酸基高分子纳米传输体系是一种自调式的药物控制释放系统,将其用于糖尿病的治疗,既可以减少胰岛素的注射次数提高患者的顺从性,又可依据血糖变化调控胰岛素的释放,减小血糖波动并降低并发症的发生。因此,该药物传递系统在糖尿病治疗方面具有较大的应用前景。以上综述了近几年PBA基葡萄糖敏感纳米药物传输体系的研究进展。虽然不同环境响应性PBA基葡萄糖敏感纳米材料的研究均取得了较大的进步,但仍然存在着一些问题亟待解决。
首先,生理条件下可逆的葡萄糖响应药物释放性能制约着药物自调式控制释放系统的发展。目前,为了提高PBA基纳米材料在生理条件下的葡萄糖响应能力,众多研究者做了大量的研究,包括在PBA功能化材料上引入特殊基团以降低其pKa,以及加入温敏或光敏基团获得双响应性纳米材料等等。然而,多环境因素敏感的葡萄糖响应药物释放传输体系的研究仍需加强。采用特殊巧妙的结构设计,综合环境敏感基团的优势,制备简单而又易于重复获得的纳米载体,在此基础上优化选择,相信获得在生理条件下具有可逆葡萄糖敏感药物释放特性的药物传递系统指日可待。
其次,葡萄糖敏感药物传递系统给药的精准性较差,仍然制约着该体系的发展。给药的精准性主要受两个方面影响:一方面,药物的生物活性会受到包药及释放过程中一些不可控因素的影响而降低;另一方面,药物载体无法准确按需释放药物。总而言之,葡萄糖敏感药物载体成为真正的“人造胰腺”任重而道远。获得精准性药物释放的前提是葡萄糖敏感纳米药物载体的可重复制备。结构简单易于制备的聚合物用于纳米载体控制药物释放更易于实现药物的精准传递。除此之外,药物制剂制备方法的优化也是提高给药精准性的有效途径。
最后,尽管大量体内外实验证明PBA具有良好的生物相容性,但是对PBA基高分子纳米载体的评价大多止步于简单的细胞毒性测试。因此,另一个研究重点是使药物载体真正用于糖尿病治疗时不具有毒副作用,并能够及时排出体外,保证其具有较好的生物相容性和生物降解性。除了细胞毒性测试,研究者应该更多地关注材料的溶血性能以及和血液蛋白的相互作用,进一步考察纳米载体的生物相容性。在此基础上,考察葡萄糖敏感纳米载体的动物实验以深入考察纳米载体的安全性和降血糖效果,推动PBA基葡萄糖敏感纳米载体的临床应用。
尽管葡萄糖敏感PBA基高分子纳米材料传递体系还有各种不完善之处,但其在糖尿病治疗方面仍具有巨大的应用潜力。
化学慧定制合成事业部摘录







