 图式1 甲基芳烃合成芳香腈反应的可能机理 图式1. Proposed mechanism for the conversion of methyl arenes into aromatic nitriles
图式1 甲基芳烃合成芳香腈反应的可能机理 图式1. Proposed mechanism for the conversion of methyl arenes into aromatic nitriles 烷烃化学键键能较高, 通过简单易得的烷烃原料来直接构建C—N键存在较大困难[24, 25].但是, 通过烷烃与亚硝酸叔丁酯的硝化/亚硝化反应得到硝基/亚硝基烷烃衍生物, 其通过进一步的化学转变能得到多种含氮化合物. 2004年, Ishii课题组[26]报道了N-羟基邻苯二甲酰亚胺催化下由环烷烃合成亚硝基环烷烃的方法, 他们以亚硝酸叔丁酯作为亚硝化试剂来构建C—N键.该方法反应条件温和, 并且具有较好的选择性(Eq. 1).
2015年, Liu课题组[27]发展了8-甲基喹啉衍生物C(sp3)—H键的硝化反应, 该反应以亚硝酸叔丁酯作为硝化试剂, Pd(OAc)2作为催化剂.反应具有良好的底物普适性, 喹啉环上带有给电子或者吸电子基团的底物都可以顺利地发生硝化反应.产物通过进一步的选择性还原, 合成出具有实用价值的四氢喹啉甲胺类化合物(Eq. 2).
2013年, Wang课题组[28]首次报道了利用亚硝酸叔丁酯作为氮源来构建C—N叁键的新方法.反应在Pd(OAc)2催化下由甲基芳烃直接转化为芳香腈, 这为该类化合物的合成开辟了新的路径.值得提出的是亚硝酸叔丁酯既是反应试剂又是氧化剂, 具有很高的原子经济性(Eq. 3).机理推测可能经过以下的过程:首先, 亚硝酸叔丁酯与N-羟基邻苯二甲酰亚胺反应, 产生一氧化氮自由基和邻苯二甲酰亚胺氮-氧自由基.随后, 邻苯二甲酰亚胺氮-氧自由基与甲基芳烃作用产生苄基自由基, 随后进一步与一氧化氮自由基发生偶联反应得到中间体A.最后, A经过异构化得到醛肟B, B在钯催化剂的作用下转化为芳香腈(Scheme 1).
 图式1 甲基芳烃合成芳香腈反应的可能机理 图式1. Proposed mechanism for the conversion of methyl arenes into aromatic nitriles
图式1 甲基芳烃合成芳香腈反应的可能机理 图式1. Proposed mechanism for the conversion of methyl arenes into aromatic nitriles
2014年, Jiao课题组[29]发展了一种亚硝酸叔丁酯合成喹喔啉N-氧化物的新方法, 该反应的特点在于:无需过渡金属催化剂, 在四丁基溴化铵(TBAB)的催化下一步构建两个C—N键, 这无疑具有实际应用价值(Eq. 4).
2015年, Li课题组[30]报道了亚硝酸叔丁酯与N-芳基亚胺在空气氛围中反应合成3-硝基吲哚衍生物.该反应经历了氧化脱氢、硝化、环化和异构化的一系列过程, 无需过渡金属参与, 反应条件温和(Eq. 5).可能经历的反应过程是先得到硝基取代的N-芳基亚胺, 其与叔丁基氧自由基反应得到自由基中间体C, 随后C经分子内环化反应得到3-硝基吲哚(Scheme 2).
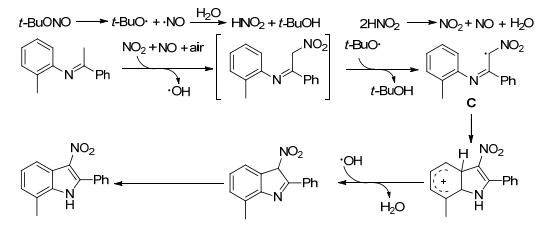 图式2 N-芳基亚胺硝化/环化反应的可能机理 图式2. Proposed mechanism for the nitration/cyclization reactions of N-aryl imines
图式2 N-芳基亚胺硝化/环化反应的可能机理 图式2. Proposed mechanism for the nitration/cyclization reactions of N-aryl imines 






