 图式3 偶氮芳烃的邻位硝化反应的可能机理 图式3. Proposed mechanism for the ortho-nitration reactions of azoarenes
图式3 偶氮芳烃的邻位硝化反应的可能机理 图式3. Proposed mechanism for the ortho-nitration reactions of azoarenes 芳香硝基化合物作为一种重要的化工中间体, 被广泛应用于医药、染料、农药等领域. 2009年, Savinov课题组[31]通过亚硝酸叔丁酯与酚类化合物在室温下反应合成硝基苯酚衍生物, 反应得到羟基邻位和对位硝化的产物, 选择性不高(Eq. 6).
2011年, Wu课题组[32]报道了一个有趣的反应, 他们利用亚硝酸叔丁酯和芳基硼酸反应构建C—N键并生成相应的芳族硝基化合物, 该反应底物适用范围广泛, 合成方法简单, 且不需要任何催化剂(Eq. 7).
2013年, Arns课题组[33]发展了亚硝酸叔丁酯与对甲苯磺酰芳胺在甲腈溶液中反应合成邻位或对位硝基取代芳香化合物的方法.该反应经历了自由基反应的过程, 反应条件温和且操作简便(Eq. 8).
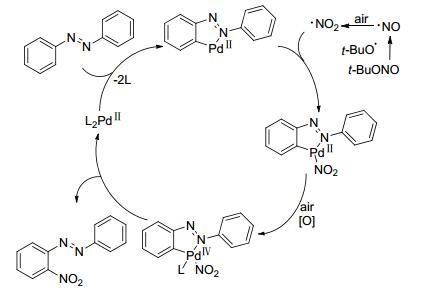
2014年, Ranu课题组[34]利用亚硝酸叔丁酯作为硝化试剂首次实现了钯催化下偶氮芳烃的邻位硝化反应.该方法能以较高的化学和区域选择性将一系列偶氮芳烃硝化, 得到在材料和药物领域中具有广阔应用前景的硝基偶氮芳烃衍生物(Eq. 9).由于反应体系中无需使用外部还原剂或强碱, 作者推测反应过程可能涉及C—H键活化的Pd(Ⅱ)/Pd(Ⅳ)途径(Scheme. 3).
 图式3 偶氮芳烃的邻位硝化反应的可能机理 图式3. Proposed mechanism for the ortho-nitration reactions of azoarenes
图式3 偶氮芳烃的邻位硝化反应的可能机理 图式3. Proposed mechanism for the ortho-nitration reactions of azoarenes
2015年, Jiao课题组[35]发展了亚硝酸叔丁酯与芳烃通过C—H活化反应构建C—N键的方法.该方法利用亚硝酸叔丁酯产生硝基自由基, 以Pd(OAc)2作为催化剂, 以O2作为氧化剂, 反应经过Pd(Ⅱ)到Pd(Ⅳ)的有氧氧化过程, 包括吡啶、嘧啶、吡唑、吡啶酮、吡啶基酮、肟和偶氮在内的导向基团都能顺利的实现C—H活化反应(Eq. 10).
2015年, Li课题组[36]发展了亚硝酸叔丁酯与喹啉氮氧化合物在无金属条件下的C-3位硝化反应.该反应中, 亚硝酸叔丁酯既作为硝基源, 又作为氧化剂.控制实验表明, 该反应涉及自由基机理(Eq. 11).
化学慧定制合成事业部摘录







