 图式4 烯烃硝化反应的可能机理 图式4. Proposed mechanism for the nitration reactions of alkenes
图式4 烯烃硝化反应的可能机理 图式4. Proposed mechanism for the nitration reactions of alkenes 烯烃化合物化学性质较活泼, 能参与到多种官能团转化反应中, 成为有机合成中最基本的合成砌块, 一直是有机合成工作者的研究热点[37–38]. 2009年, Beller课题组[39]报道了亚硝酸叔丁酯与烯烃在室温下通过铁催化合成肟类化合物的反应.反应过程中通过GC-MS检测到三乙氧基硼, 因此推测反应的关键步骤是得到三价烷基铁中间体, 该中间体能进一步与亚硝酸叔丁酯反应得到目标产物(Eq. 12).
2011年, Taniguchi课题组[40]进一步发展了亚硝酸叔丁酯与烯烃的反应.与之前Beller课题组不同的是, 他们无需任何催化剂, 室温下就能构建C—N键从而合成β-硝基醇.稍显遗憾的是, 其产物为单硝基化和双硝基化的混合物, 而且产率较低(Eq. 13).
2013年, Maiti课题组[41]报道了亚硝酸叔丁酯在四甲基哌啶(TEMPO)促进下与芳基丙烯酸化合物反应得到(E)-硝基芳基乙烯衍生物的方法.当反应体系中缺少TEMPO时, 会得到E/Z两种构型的混合产物.进一步研究表明TEMPO在此反应中的作用是与烷基自由基相结合, 使得脱羧过程符合newman投影式空间构型, 从而选择性得到E构型产物.但是, 烷基丙烯酸化合物在该条件下不能发生脱羧/硝化反应(Eq. 14).
2013年, Taniguchi课题组[42]报道了温和条件下通过有氧氧化和C(sp3)—H键氧化的烯烃多官能团化反应.该反应不需要添加金属催化剂, 在常温下就能进行, 符合绿色化学的要求.但是该方法产物的产率和选择性都有待提高(Eq. 15).
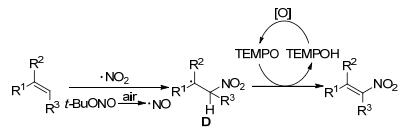
2013年, Maiti课题组[43]利用亚硝酸叔丁酯与烯烃反应合成硝基烯烃衍生物.反应在TEMPO与空气的反应条件下进行, 以1, 4-二氧六环作为反应溶剂.反应中O2起到了致关重要的作用, 能够把亚硝酸叔丁酯产生的亚硝基自由基氧化成硝基自由基, 当反应在氮气氛围下反应时产率极低(Eq. 16).该反应可能的反应过程为:亚硝酸叔丁酯均裂产生的亚硝基自由基经氧气氧化形成硝基自由基, 其进一步与烯烃发生加成反应得到烷基自由基中间体D, 随后D在TEMPO作用下发生消去反应得到目标产物(Scheme 4).
 图式4 烯烃硝化反应的可能机理 图式4. Proposed mechanism for the nitration reactions of alkenes
图式4 烯烃硝化反应的可能机理 图式4. Proposed mechanism for the nitration reactions of alkenes
2014年, Han课题组[44]报道了亚硝酸叔丁酯与肟类化合物的环化反应.通过实验证明反应中间体为肟形成的氮-氧自由基, 而不是亚硝酸叔丁酯裂解产生的亚硝基自由基.该方法反应条件温和, 底物普适性良好, 是合成异噁唑环的有效路径(Eq. 17).
2014年, Jiao课题组[45]进一步发展了亚硝酸叔丁酯与烯酰胺类化合物的环化反应, 通过对反应底物的巧妙设计合成出具有实际应用价值的硝基取代吲哚酮衍生物.该反应涉及亚硝基自由基/硝基自由基对碳碳双键的自由基加成反应以及烷基自由基对苯环的分子内环化反应(Eq. 18).
2015年, Tan课题组[46]在研究中进一步发展了亚硝酸叔丁酯与烯烃的双官能团化反应.他们从廉价易得的芳基烯烃出发, 无需任何金属催化剂, 在空气氛围中常温下反应, 高效合成硝基酮肟衍生物(Eq. 19). 2016年, Kuhakarn课题组[47]也报道了类似反应, 与Tan课题组的工作相比, 反应的选择性较差, 在得到硝基酮肟衍生物的同时会生成少量的硝基烯烃副产物.但是该方法能进一步拓展到乙烯基杂芳族化合物, 可以合成具有潜在生理活性的复杂杂环化合物.
2016年, Li课题组[48]实现了温和条件下亚硝酸叔丁酯参与的烯烃双官能团化反应.通过烯烃、亚硝酸叔丁酯和芳基亚磺酸钠这三组分之间的反应, 一步法构建C—N键和C—S键, 为α-磺基乙内酰胺肟衍生物的合成提供了一种简单快捷的方法(Eq. 20).
化学慧定制合成事业部摘录







