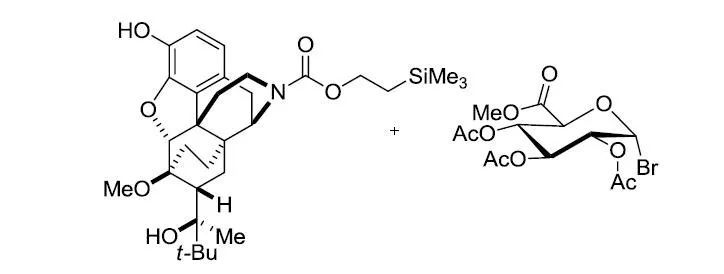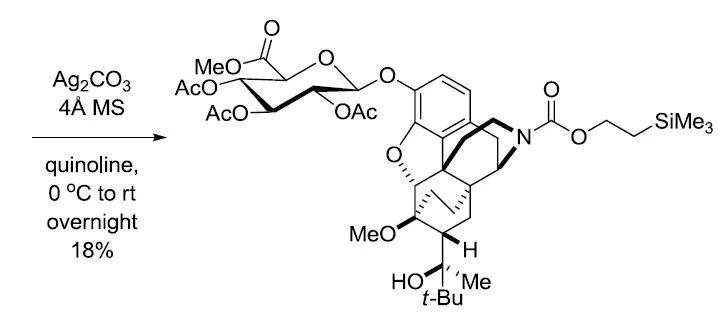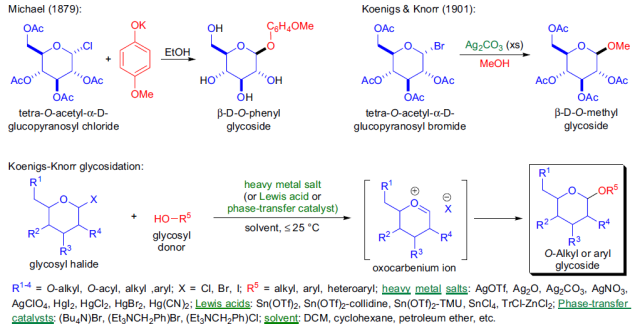
1879年A. Michael第一次报道了合成糖苷的反应,2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖基氯和4-甲氧基苯酚的钾盐在乙醇中反应,生成相应的β-D-O-苯基葡萄糖。但是乙酰基在强碱性条件下会发生水解,因此此条件只能用于制备芳香基葡萄糖,否则乙酰基会遭到破坏。二十年后,在1901年,W. Koenigs和E. Knorr改进了此反应,他们将四-O-乙酰基-α-D-吡喃葡萄糖基溴与过量的碳酸银在甲醇中反应得到了相应的β-D-O-甲基葡萄糖,而且乙酰基都完整保留。通过糖基卤化物和醇或酚在重金属盐或路易斯酸存在下制备烷基和芳基-O-糖苷的反应被称为Koenigs-Knorr糖苷化反应。
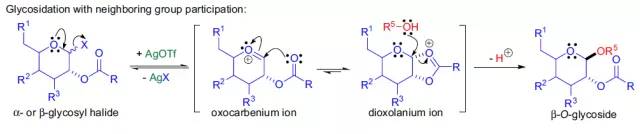
由于此反应的高非对映立体选择性,亲核试剂的进攻应该遵循SN2机理,而且2位的乙酰基有邻基参与效应,形成了一个二氧烷基鎓离子和氧羰基鎓离子互变的中间体。
反应特点
1)糖基卤化物可以利用卤化试剂卤化异头碳上的羟基得到;2)各种糖基卤化物的反应活性和稳定各不同,主要和卤原子的种类和糖环上的取代基的种类有关:氯比溴稳定,但碘代物通常很不稳,糖环上的吸电子取代基会增加其稳定性;3)糖基卤化物的反应活性还和反应的溶剂,温度和一些辅助试剂(路易斯酸和重金属盐)有关;4)反应具有立体定向性,取代总是发生在异头碳(C1)上,因此具有很高的非对映立体选择性;5)当邻基参与不能进行时(如R4=O-alkyl),受端基异构效应的影响形成α-O-糖;6)当可以进行邻基参与时(如R4=O-acyl),可以由α-糖基卤化物得到β-O-糖;7)反应辅助试剂或催化剂通常是溶于非质子性溶剂中的银盐或汞盐,反应副产物酸通常用一些碱(如碳酸银,三甲基吡啶)中和;8)由于糖基卤化物的热力学稳定性很差,因此反应通常在室温或低于室温下进行。
反应缺点:1)糖基卤化物对热不稳定,制备的条件比较苛刻;2)糖基卤化物可以发生水解或1,2-消除;3)反应的辅助试剂通常需要等摩尔量加入,并且它们通常是有毒的或具有爆炸性。
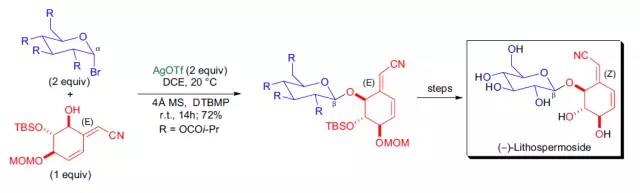
【Helv. Chim. Acta 2003, 86, 661-672】
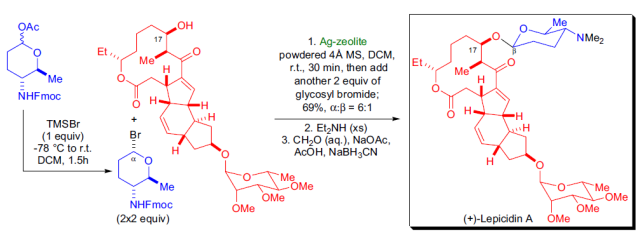
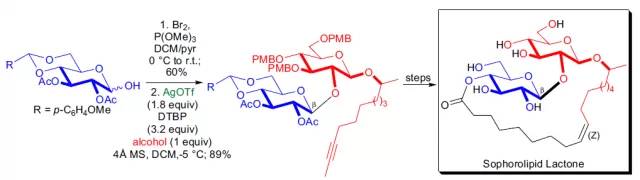
【J. Org. Chem. 2000, 65, 8758-8762】
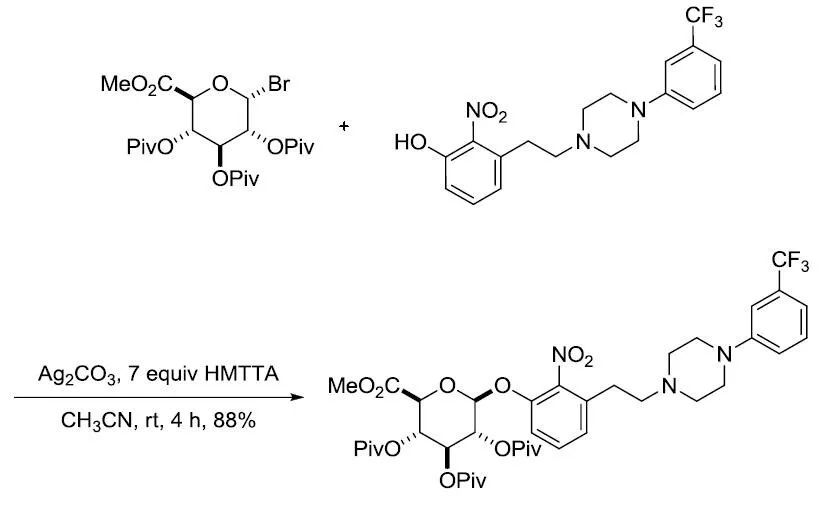
【J. Org. Chem. 2004, 69, 1097-1103】
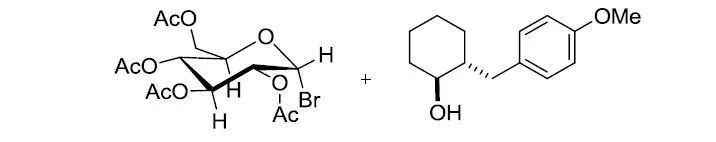
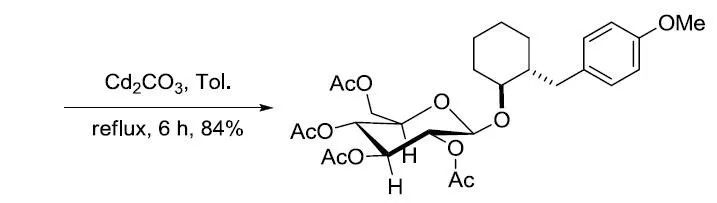
【Molecules 2004, 9, 902-912】
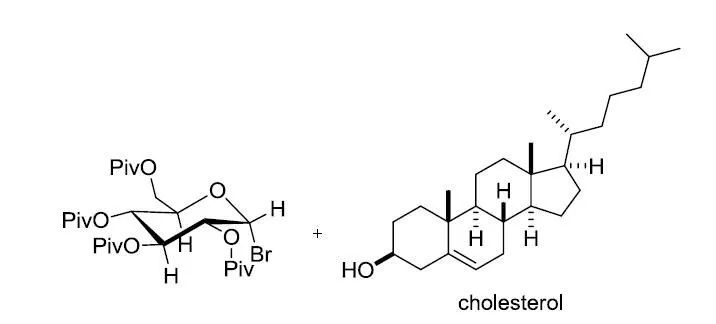
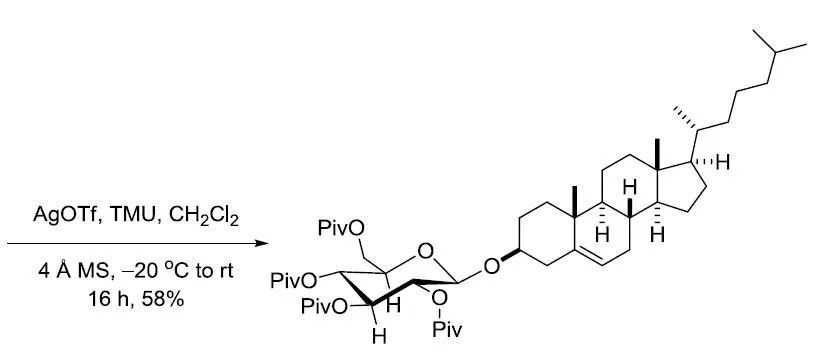
【Monat. Chem. 2006, 137, 365-374】