1 锂离子电池的历史
电池是一种将化学能转变为电能的装置。金属锂的密度为0.534 g/cm,在金属元素中为最小,其相对于标准氢电极的电极电位为-3.045 V,是金属元素中电负性最低的金属。金属锂电池的研究最早可以追溯到二十世纪六十至七十年代,当时以金属锂作为负极,以TiS2等过度金属硫化物以及MoS2、V205等过度金属氧化物为正极。然而,该电极体系在充电过程中,负极金属锂表面电位分布不均会导致锂离子被还原时在金属锂表面不均匀沉积形成树枝状的锂晶体,当结晶到较大阶段时,锂枝晶会刺穿隔膜,使电池的正负极导通,形成短路,最终引发电池爆炸等安全事故。
为了解决金属锂负极的安全问题,科学家们寻求可替代金属锂的负极材料,比如Li-A1合金等,但长时间反复的循环,合金化和去合金化过程仍然会使电极材料产生较大的体积效应,最终致使电极粉末化,容量衰减。随后,Armand
等科学家提出了以石墨类等层状材料可以作为锂离子嵌入脱出的载体进行储存锂,从而代替金属锂和合金锂负极,引起了较大的关注。同时,在正极方面的研究进展则以Goodenough等合成出了嵌锂化合物LiMO2(其中M代表Co,Ni,Mn等)为代表,锂离子能在该系列的化合物中可逆的嵌入及脱出。随后,在1991年,日本sony公司发布了首个商用的锂离子电池,即是以石墨类材料作为负极,以高电位的LiC0O2作正极,溶解于EC+DEC的LiCl04作为电解液。而此后,锂离子电池便得到了大规模的发展及应用。
2 锂离子电池的工作原理
以商用化的锂离子电池为例,即电池负极采用的是石墨类材料,正极为LiC0O2。其工作原理如图1所示,在充放电过程中,锂离子分别在正极和负极材料中嵌入脱出,从而对外释放电能。在充电过程,锂离子从LiC0O2中脱出,嵌入到石墨层间;而放电过程则正好与此相反,即锂离子又从石墨类材料中脱出,而嵌入到LiC0O2中。具体的电化学反应如下所示:
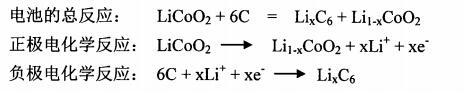
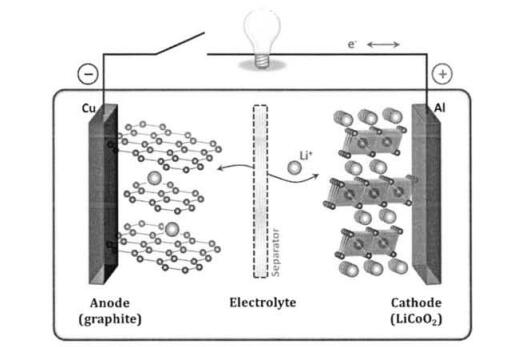
图1 锂离子电池的工作原理图
3 锂离子电池的优点
锂离子电池能被广泛的应用于生活中各个方面,源自于自身独特的优势:首先是工作电压高,单体锂离子电池的工作电压为3.6V,约镍氢镍镉电池的3倍,高的电势可以提供更高的能量密度;其次,锂离子电池的比能量密度(Wh/Kg,Wh/L)高,一般在110-150Wh/Kg或270wh/L,是铅酸电池的6倍,镍氢镍镉电池的2-3倍,高的比能量密度能使在满足同等比容量的条件下,使电池的重量大幅减小。再次,锂离子电池的循环寿命较长。正常情况下可充放电次数达1000次以上,高于其他类型的二次电池;此外,锂离子电池还拥有自放电较小,无容量的记忆效应,对环境友好等优点。







