[5-6-5]含氧三元并环结构在天然产物中广泛存在,具有重要的医药和合成价值,如Phomactin A是一种血小板激活因子。然而这种含氧三元并环一般合成方法复杂,并且需要多步反应实现。最近,重庆大学药学院的闫海龙教授(点击查看介绍)通过分子内的[4+2]反应发展了一种高效手性构建[5-6-5]含氧三元并环结构的方法。他们使用易于制备的金鸡纳碱硫脲分子作为催化剂,反应在室温条件下进行,具有优秀的立体选择性和原子经济性。
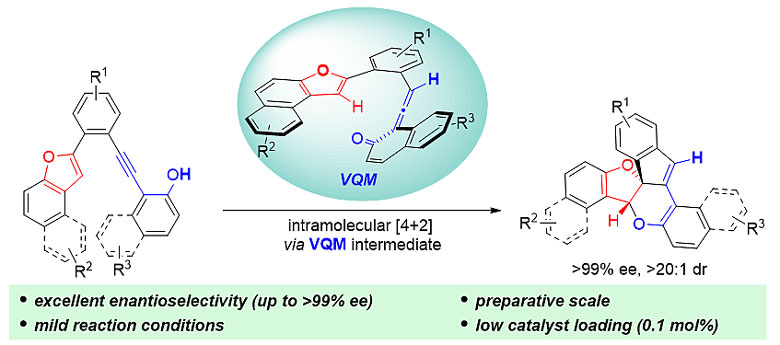
作者最初选用商业可得的金鸡纳碱催化剂对模板反应进行考察,反应可以顺利进行,但是手性控制不够理想(ee = 77%)。随后作者选用金鸡纳碱硫脲催化剂,根据已知文献的报道,作者设想催化剂的硫脲官能团能够与底物形成氢键作用,从而获得更好的立体选择性,在进行一系列的反应条件优化以后,立体选择性可以达到99%以上。
底物拓展的过程中,作者系统考察了含有吸电子和供电子取代基的底物,反应都可以取得理想的结果。对于部分含有杂原子的底物,反应的收率有所降低(63%),但手性控制依然很好(ee = 99%)。同时,为了考察该方法的实用性,作者进行了反应规模的放大实验,对于克量级规模的反应,反应的立体选择性和对映选择性都不会受到明显的影响。
作者通过氘代实验对反应机理进行了研究,首先催化剂与底物作用,攫取酚羟基的氢,原位生成联烯酮中间体(VQM),并通过氢键作用与底物结合,提供手性环境。原位生成的联烯酮中间体与分子内苯并呋喃上的双键发生[4+2]反应,从而实现手性含氧三元并环的一步构建。该过程还伴随着苯并呋喃去芳构化的过程。作者通过高分辨质谱对反应过程进行了监测,捕捉到催化剂与底物结合的过渡态。

图1. 反应的催化循环
此外,作者对催化剂的催化效率进行了考察,当催化剂负载量降低至0.1%时,延长反应时间,依然可以得到良好的收率和立体选择性(75% yield,98% ee)。
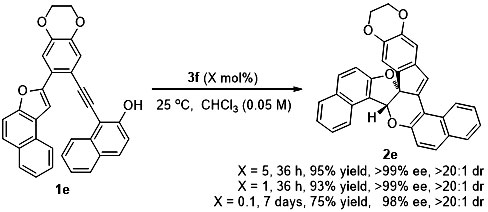
图2. 催化剂负载量的考察
该方法为手性含氧三元并环的构建提供了新的途径,合成方面的应用以及在其他类型化合物骨架构建的应用研究仍在进行中。这一成果近期发表在Angew. Chem. Int. Ed. 上,论文的第一作者为重庆大学的硕士研究生吴孝言。
化学慧定制合成事业部摘录







