引言
硝基化合物是重要的含能材料,在军事上也有着广泛的用途,因此近年来在炸药合成的研究领域中受到很大的关注。而其中的含氮杂环化合物在自然界来源广泛,也是生命体二级代谢产物中常见的结构单元,由于它的药理活性和生理活性独特、内吸性高、毒性也低,因此在医药和农业方面被广泛应用。此外,含氮杂环化合物也被用作除草剂、杀虫剂、杀菌剂等[1]。含氮杂环硝基化合物的分类主要有:吡唑类化合物如4-硝基吡唑和3,4-二硝基吡唑,咪唑类化合物如2,4-二硝基咪唑和1-甲基-2,4-二硝基咪唑,吡嗪类化合物如2,6-二甲氧基-3,5-二硝基吡嗪等。富氮化合物都是具有高能量密度的优良含能材料,也是近年来氮杂环硝基化合物的研究热点。
这些含能化合物的合成大多数都是要经过原料或中间体的硝化反应制得,而 采用的硝化方式一般是硝酸硝化或是硝酸-乙酸酐、硝酸盐-硫酸硝硫混酸等混酸硝化剂硝化。由含氮杂环化合物通过硝化反应制备的硝基唑类化合物是一类新型的高能化合物,由于分子结构中具有C-N,N-N,N-O等高能化学键,故使得这类化合物不仅具有高氮低碳氢的特点,还具有较高的密度,更容易达到氧平衡,且其中的一些硝基唑类化合物属于高能低钝感的优良含能材料[2,3]。因为唑类氮杂环分子的结构具有可改良性、紧密性和稳定性等优点,所以以其为母体的硝化、衍生等工作相对来说都变得简单易行。
目前氮杂环化合物的硝化反应主要存在三种不足:
(1)安全性生产问题。硝化反应的反应过程中会快速强放热,若控制不当,极易引起温度飞升、冒料,甚至会产生爆炸的危险。20世纪70年代以来,国外研究的绝热硝化技术在一定程度上提高了操作安全性,但不能从根本上解决硝化快速强放热引发的危险。
(2)环境污染问题。目前氮杂环化合物的硝化合成工艺会带来大量的废酸和富含有机物的酸性废水,这些酸性废水可能会腐蚀设备,在生产成本增加的同时也带来严重的环境污染问题。为了解决这个问题,化学工作者开展了大量绿色硝化技术的研究,如液相载体硝化技术,气相硝化技术等,但还有众多的技术问题存在,尚难实现工业化。
(3)选择性硝化问题。一直以来国内外化学工作者都在重点研究如何提高有机物硝化的选择性,主要通过两种手段:寻求适宜的催化剂和合适的硝化剂。例如采用离子交换树脂、沸石、离子液体、复合金属氧化物等进行催化[4],可以使得底物硝化选择性在一定程度上得到控制改善,但这些催化剂都会存在成本高昂、操作复杂、回收不易、收率较低之类的问题。由此可见,解决有机化合物硝化反应问题的关键是选择更为精确、稳定、节能的控制系统和高选择性的硝化技术与探索氮杂环化合物的硝化机理。
以微通道反应器为代表的微化工技术是一项新型的环保的化工技术,与传统化学工业技术相比,能够实现更环保而且占地面积非常小,同时又能合理利用资源不会造成能耗高,已引起能源化工、环境工程等自然科学界其他领域的高度重视[5,6]。微通道反应器是利用精密加工技术制造的特征尺寸在几十微米到几毫米之间的连续反应器,其内部特殊的通道结构可以大幅强化传质效果,为硝化反应的精确、稳定、安全进行提供了可行的解决方案。
3,4-二硝基吡唑(DNP)是一种性能优良的硝基唑类含能化合物,分子质量为158,分子式为C3H2N4O4,为白色结晶固体,熔点在85°C,密度为1.87g/cm3,常温下易溶于乙腈和甲醇等有机溶剂,具有熔点低、密度高、氮含量高、爆速高、氧平衡好等优点。本文研究了3,4-二硝基吡唑中间体——N-硝基吡唑在微反应器内的合成过程,在微反应器中,以吡唑为原料,在硝酸-乙酸酐体系进行硝化,通过研究反应温度、吡唑与硝酸的摩尔比、硝酸与乙酸酐的体积比、停留时间等条件对反应的影响,得到最佳硝化反应条件。
一 反应机理
以吡唑为原料,在硝酸-乙酸酐体系下硝化合成N-硝基吡唑,再在苯甲腈中热重排制备3-硝基吡唑,之后在硝硫混酸体系下硝化合成3,4-二硝基吡唑。该路线的反应方程式如下:
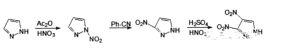
硝酸-乙酸酐体系是一种温和的硝化体系,常用于N原子的硝化。由于吡唑来源广泛,所使用的硝化体系均为常用的硝化体系,反应温度不高,也易于控制,合成步骤简单易行,是一种合成3,4-二硝基吡唑很好的方法。
二 实验部分
2.1 实验装置及流程
实验中所选用的微反应器为碳化硅材质微反应器,具有良好的耐腐蚀性。
实验过程中,首先通过控温系统将微反应器内温度控制到所需温度,吡唑溶于冰醋酸中配置成一定浓度的吡唑冰醋酸溶液,和一定比例的硝酸-乙酸酐混合硝化剂分别通过四氟计量泵以一定比例输送至微反应器,在微反应器内进行硝化,反应完毕的混合液自反应器出口流至接收瓶;将接收瓶中的溶液倒入碎冰中,过滤,冰水洗涤,真空干燥得白色结晶固体,即目标中间产物N-硝基吡唑。称重后进行液相色谱分析产品纯度,计算产品收率。优化实验条件,最终得到最佳工艺参数。
三 实验结果
实验过程中主要研究了反应温度、吡唑与硝化剂的摩尔比、硝酸与乙酸酐的体积比、停留时间对硝化反应的影响。
3.1 反应温度对吡唑硝化的影响
为了考察反应温度对微通道反应器中吡唑硝化反应的影响,控制进料摩尔比n(硝酸):n(吡唑)=1.1:1,硝酸与乙酸酐体积比1:5,停留时间150s,在不同温度下进行吡唑硝化实验,结果见图2。
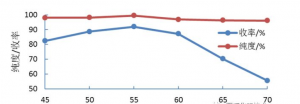
图2 反应温度对吡唑硝化的影响
反应温度低于45°C时,微反应器中会有固体产生导致反应器堵塞;随着反应温度的升高,N-硝基吡唑的收率和纯度都逐渐增大;当温度到达55°C时,收率达到最大值92.2%;但是当温度继续升高时,产率反而有所下降,原因可能是因为温度过高硝酸分解不利于硝化反应的正向进行;当温度到达70℃时,N-硝基吡唑的收率急剧下降,因此选择55°C作为最佳反应温度。
3.2 硝酸与吡唑摩尔比对吡唑硝化的影响
硝酸的用量对硝化反应的影响至关重要。为了考察吡唑与硝酸的摩尔比对反应的影响,改变吡唑与硝酸的摩尔比,控制反应温度为55℃,控制停留时间150s,硝酸与乙酸酐体积比1:5,实验结果见图3。
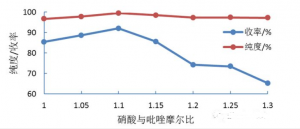
图3 硝酸与吡唑摩尔比对吡唑硝化的影响
由上图可以看出,当硝酸的量较少时,随着硝酸与吡唑摩尔比的增加,更多的硝酸参与了反应,N-硝基吡唑的收率和纯度逐步提高;当硝酸与吡唑的摩尔比为1.1时,N-硝基吡唑的收率达到最大值92.2%;但当硝酸量继续增加时,N-硝基吡唑的收率和纯度却不断下降。为了使收率尽量高,同时考虑经济成本,硝酸与吡唑摩尔比应选择1.1:1。
3.3 乙酸酐与硝酸体积比对吡唑硝化的影响
为了考察乙酸酐和硝酸体积比对硝化结果的影响,改变乙酸酐和硝酸体积比,控制反应温度55°C,进料摩尔比n(硝酸):n(吡唑)=1.1:1,控制停留时间150s,实验结果见图4。
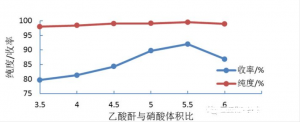
图4 乙酸酐与硝酸体积比对吡唑硝化的影响
由上图可以看出,随着乙酸酐和硝酸体积比不断增大,N-硝基吡唑的收率和纯度也逐渐增大;当乙酸酐和硝酸体积比达到5.5:1时,收率达到最大值92.2%,但当体积比继续增大时,收率会略有降低。这是由于在硝酸和乙酸酯硝化体系中,硝酸首先与乙酸酐结合生成乙酰硝酸酯,乙酰硝酸酯再与硝酸反应生成五氧化二氮,然后五氧化二氮在反应中产生硝酰阳离子(NO2+,即有效的硝化进攻试剂),可以看出,乙酸酐的用量直接决定了反应中产生NO2+的浓度,从而决定了硝化反应进行的程度,选择乙酸酐与硝酸体积比5.5:1。
3.4 停留时间对吡唑硝化的影响
为了考察停留时间对硝化结果的影响,控制反应温度55°C, n(硝酸):n(吡唑)=1.1:1,乙酸酐与硝酸体积比5.5:1,改变进料流速,控制不同的停留时间,考察该因素对硝化反应的影响,结果如下图5所示。
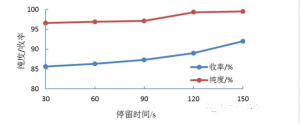
图5 停留时间对吡唑硝化的影响
由上图可知,随着进料流速不断增大,反应物在微通道反应器内停留时间逐渐减小,N-硝基吡唑的收率逐渐减小;当停留时间为150s时,N-硝基吡唑的收率和纯度最大。另一方面,当停留时间小于120s时,N-硝基吡唑的纯度下降明显,因此应选择反应的停留时间为150s。
四 结论
本文研究了在微反应器中以吡唑为原料,乙酸酐-硝酸作为硝化剂,进行硝化反应制备N-硝基吡唑的反应过程,并分别考察了反应温度、吡唑与硝酸的摩尔比、乙酸酐与硝酸体积比、停留时间等实验条件对N-硝基吡唑收率和纯度的影响。在反应温度55°C,进料摩尔比n(硝酸):n(吡唑)=1.1:1,乙酸酐与硝酸体积比5.5:1,停留时间150s的条件下,吡唑硝化达到最优效果,此时N-硝基吡唑的收率为92.2%,纯度99.5%。
参考文献
[1] Siddiqui N, Rana A, Khan S A, et al. Synthesis of benzothiazole semicarbazones as novel anticonvulsants–the role of hydrophobic domain.[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(15):4178.
[2] Mandal A K, Pant C S, Kasar S M, et al. Process Optimization for Synthesis of CL-20[J]. Journal of Energetic Materials, 2009, 27(4):231-246.
[3] Fischer N, Fischer D, Klapotke T, et al. Pushing the limits of energetic materials – the synthesis and characterization of dihydroxylammonium 5,5prime-bistetrazole-1,1prime-diolate[J]. Journal of Materials Chemistry, 2012, 22(38):20418-20422.
[4] Nowrouzi N, Jonaghani M Z. Nitration of aromatic compounds under neutral conditions using the Ph2PCl/I2 /AgNO3, reagent system[J]. Cheminform, 2012, 43(1):5081-5082.
[5] Hessel V, Hardt S, L we H. Chemical micro process engineering: fundamentals, modeling and reactions [J]. Weinheim: Wily-VCH, 2004.
[6] Hessel V, L we H, Muller A, et al. Chemical micro process engineering: processing and plants [J]. Weinheim: Wily-VCH, 2005.







