镍催化的2- 甲氧基萘与4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯的交叉偶联
 |
1.程序(注1)
A. 4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯(1)。单颈1L圆底烧瓶(29/32接头)配有5厘米涂有特氟隆的足球形磁力搅拌棒。4-(甲氧基 – 羰基)苯基硼酸(10.0g,55.6mmol,1.0当量)(注2)和2,2-二甲基-1,3-丙二醇(6.40g,61.5mmol,1.1当量)(注3)是添加。该烧瓶配有连接适配器(上外接头29/32,下内接头15/25)和Dean-Stark冷凝器(15/25接头),烧瓶中装有甲苯(450 mL)(注4))。将烧瓶浸入硅油浴中,将浴加热至130℃(图1)。


图1.硼酸酯1形成的反应设置
将混合物在氩气氛下搅拌回流2小时(注5)。将得到的无色溶液冷却至室温。然后将混合物转移至1L分液漏斗中并用自来水(80mL×3)和盐水(70mL×1)洗涤。将有机层用无水MgSO 4(15g)干燥(注释6),用褶皱滤纸(#2滤纸)过滤,得到无色溶液,将其在旋转蒸发器上浓缩(50℃,780至60℃)。然后将得到的残余物在真空(0.80mmHg)中干燥 1小时。将所得的无色固体溶解在230毫升的Et 2 ö – 己烷(注通过在水浴(50℃)上加热溶液,得到7和8)(4:1,Et 2 O:己烷)。将溶液在旋转蒸发器(50℃,780至400mmHg)上浓缩,得到无色沉淀。沉淀物通过Büchner漏斗(直径11cm)用#1滤纸过滤,并用冷己烷(10℃)洗涤(注释7),得到标题化合物1,为无色板(12.5g,50.4mmol,91%) )(图2)(注9和10)。


图2. 4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯
B. 4-(萘-2-基)苯甲酸甲酯(2)。单颈,100 mL圆底烧瓶(29/32接头,烧瓶A),200 mL圆底Schlenk烧瓶(29/32接头,烧瓶B),回流冷凝器(15/25接头),a连接适配器(上外接头29/32,下内接头15/25)和4厘米涂有特氟隆的足球形磁力搅拌棒在120℃的烘箱中干燥2小时。Flask B的侧颈用橡胶隔膜密封。回流冷凝器和连接适配器连接到氩气/真空管线,底部用烧瓶A盖住。反应装置通过用热风枪加热进一步真空干燥(0.80mmHg)并冷却至室温。温度(图3)。


图3.带回流冷凝器的烧瓶A.
将装有磁力搅拌棒和橡胶隔膜的烘箱干燥的烧瓶B放入装有氩气的手套箱中。在手套箱中,Ni(cod)2(960 mg,3.49 mmol,0.1当量)(注11),PCy 3(2.00 g,7.13 mmol,0.2当量)(注12),CsF(5.80 g,38.2 mmol, 1.1当量)(注释13),2-甲氧基萘(5.50g,34.8mmol,1.0当量)(注释14)和4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯(1)(9.50g,38.3mmol,1.1当量)(注15)按顺序添加到Flask B中。烧瓶B的剩余颈部用隔膜盖住(注释16)。将烧瓶B从手套箱中取出,并通过除去烧瓶A快速连接到回流冷凝器(图4)。


图4. Flask A替换为Flask B
将反应装置抽空并用氩气回填三次,并使用氩气歧管系统在整个反应过程中保持氩气氛。通过注射器通过隔膜向烧瓶中加入无水甲苯(50mL)(注释17),然后关闭Schlenk活塞。将得到的混合物在室温下搅拌10分钟,得到深绿色溶液(图5)。将烧瓶浸入已经预热至125℃的硅油浴中,并将混合物在搅拌下回流17小时,得到黑色混合物(图6)。
 |
 |
|
图5.解决方案的初始颜色
|
图6.回流17小时后
|
冷却至室温后,将混合物通过硅藻土垫(注18)(7cm宽,2cm高)过滤,并用EtOAc(400mL)洗涤垫(注释19),得到橙色溶液(图7)(注20)。将所得溶液在旋转蒸发器(50℃,780至60mmHg)上浓缩,真空干燥(0.80mmHg),得到琥珀色固体(图8)。
 |
 |
|
图7.硅藻土过滤
|
图8.浓缩后
|
将固体溶解在二氯甲烷(200mL)中(注释21),并向溶液中加入硅胶(48g)(注释22)。将混合物在旋转蒸发器(38℃,780至250mmHg)上浓缩。将得到的固体通过柱色谱法在硅胶上纯化,得到标题化合物2,为无色固体(6.12克,23.3毫摩尔,67%)(图9)(注23,24,和25)。


图9. 4-(萘-2-基)苯甲酸甲酯
2.备注
1.在进行每个反应之前,应对每种化学物质和实验操作进行彻底的危害分析和风险评估,并按照计划的规模和实验程序进行实验。进行风险评估和分析与化学品有关的危害的指南可参见“实验室中的谨慎做法”第4章(美国国家科学院出版社,华盛顿特区,2011年;全文可免费获取)。电话 :https://www.nap.edu/catalog/12654/prudent-practices-in-the-laboratory-handling-and-management-of-chemical。另见“识别和评估研究实验室中的危害”(美国化学学会,2015年),可通过相关网站“研究实验室的危害评估”获取, 网址为https://www.acs.org/content/acs/en/about /governance/committees/chemicalsafety/hazard-assessment.html。在此程序的情况下,风险评估应包括(但不一定限于)与4-(甲氧基羰基)苯基硼酸,2,2-二甲基-1,3-丙二醇,甲苯相关的潜在危害的评估,硫酸镁,乙醚,己烷,双(环辛二烯)镍,三环己基膦,氟化铯, 2-甲氧基萘,乙酸乙酯,二氯甲烷和硅胶。
2. 4-(甲氧基羰基)苯基硼酸(98%)购自Combi-Blocks并按原样使用。
3. 2,2-二甲基-1,3-丙二醇(> 98.0%)购自TCI并按原样使用。
4. 甲苯(> 99.0%)购自FUJIFILM Wako Pure Chemical Corporation并按原样使用(检验器)。甲苯(> 99.0%)购自Kishida Chemical Co.Ltd。并按原样使用(提交者)。
5.将反应搅拌2小时后,收集约2mL水。
6.无水MgSO 4(95.0%)购自FUJIFILM Wako Pure Chemical Corporation并按原样使用。
7. 的Et 2 ø(99.0%)由FUJIFILM和光纯药公司购入,并用作接收(跳棋)。Et 2 O(99.0%)购自Kishida Chemical Co.Ltd。并按原样使用(提交者)。
8. 己烷(95.0%)购自Kanto Chemical Co.Ltd。并按原样使用(检验器)。己烷(95.0%)购自Kishida Chemical Co.Ltd。并按原样使用(提交者)。
9.当反应在半浓缩下进行时,得到6.08g(88%)产物。
10. 4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯 (1)具有下列物理性质:熔点113-115℃; IR(膜):2955,1720,1479,1424,1308,1277,1254,1129,1019,708,641,498cm -1 ; 1 H NMR pdf(400MHz,CDCl 3)δ:1.03(s,6H),3.78(s,4H),3.91(s,3H),7.86(d,J = 8.2Hz,2H),8.00(d,J = 8.7Hz,2H); 13 C NMR pdf(100MHz,CDCl 3)δ:21.9(2C),31.9,52.1,72.3(2C),128.5(2C),131.8,133.7(2C),167.3; HRMS(DART)m / z计算值C 13 H 18 BO 4 [M + H]+ 249.1293,发现249.1283; 肛门。C 13 H 17 BO 4计算值:C,62.94; H,6.91。实测值:C,62.77; H,6.86。
11. 镍(COD)2(> 98%)自Strem化学品购买并原样使用。将其真空包装(图10)并储存在4℃(检查器)。提交者将其储存在0°C的氮气手套箱中。

图10.真空包装的催化剂
12. PCy 3(> 94.0%)购自Aldrich并按原样使用。
13. CsF(> 99.0%)购自TCI并按原样使用。
14. 2-甲氧基萘(> 99.0%)购自FUJIFILM Wako Pure Chemical Corporation并按原样使用。
15.将4-(5,5-二甲基-1,3,2-二氧杂硼杂环己烷-2-基)苯甲酸甲酯在真空(0.80mmHg)中干燥6小时,然后转移到充满氩气的手套箱中。
16.提交者报告说,如果在氮气填充的手套箱外进行操作,Ni(鳕鱼)2将失活,这种反应可能不会进行。
17.无水甲苯(99.5%)购自FUJIFILM Wako Pure Chemical Corporation并在用于Glass Contour溶剂分配系统(Nikko Hansen&Co.Ltd。)之前干燥。
18.硅藻土购自FUJIFILM Wako Pure Chemical Corporation并按原样使用(检验员)。Celite购自Kishida Chemical Co.Ltd。并按原样使用(提交者)。
19. 乙酸乙酯(99.0%)购自关东化学股份有限公司购入,并用作接收(跳棋)。EtOAc(99.0%)购自Kishida Chemical Co.Ltd。并按原样使用(提交者)。
20.粗产物的TLC分析如下所示。产物和硼酸酯1在己烷 / 二氯甲烷(1/1,v / v)中的Rf值分别为0.21和0.10。通过荧光在硅胶60F 254板(TLC Silica gel 60 F 254,购自Merck KGaA)上用UV光(254nm)观察产物的斑点。
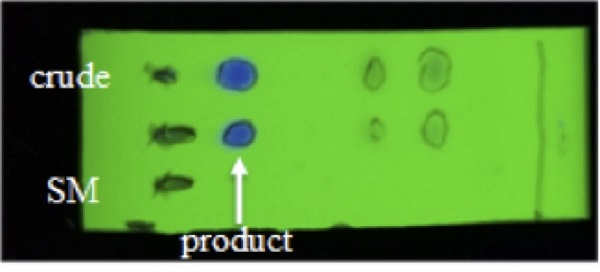

图11.步骤B反应混合物的TLC分析
21. 二氯甲烷(> 99.0%)购自Kanto Chemical Co.Ltd。并按原样使用(检验器)。二氯甲烷(> 99.0%)购自FUJIFILM Wako Pure Chemical Corporation并按原样使用(提交者)。
22.硅胶(硅胶60,0.040-0.063mm)购自Merck KGaA并按原样使用。
23.使用450g硅胶(硅胶60,0.040-0.063mm,购自Merck KGaA)进行柱色谱。使用己烷 / 二氯甲烷(5/1,v / v)将其在7cm直径的柱中湿包装,并将吸附有粗物质的二氧化硅加载到柱上。柱用2.5升的洗脱己烷 /二氯甲烷(5/1,体积/体积)中,然后5.0升的己烷 / 二氯甲烷(3/1,体积/体积),最后10升的己烷 / 二氯甲烷(5/2,v / v)。将馏分收集在500mL瓶中。合并级分16至34,并在旋转蒸发器(38℃,780至60mmHg)上浓缩,并使用加热室在80℃下真空(0.80mmHg)干燥12小时。


图12.柱级分的TLC分析
24.当反应在半标度下进行时,得到3.02g(66%)产物。
25. 4-(萘-2-基)苯甲酸甲酯(2)具有下列物理性质:熔点154-156℃; IR(膜):1716,1601,1436,1275,1190,1108,851,818,772,693,471,438cm -1 ; 1 H NMR pdf(400MHz,CDCl 3)δ:3.96(s,3H),7.49-7.56(m,2H),7.75-7.82(m,3H),7.87-7.96(m,3H),8.10(d ,J = 1.6Hz,1H),8.14-8.17(m,2H); 13 C NMR pdf(100MHz,CDCl 3)δ:52.2,125.2,126.3,126.4,126.5,127.3(2C),127.7,128.3,128.7,128.9,130.2(2C),132.9,133.5,137.3,145.5,167.0 ; HRMS(DART)m / z计算值C 18 H 15 O.2 [M + H] + 263.1067,实测值263.1059; 肛门。C 18 H 14 O 2的计算值:C,82.42;实测值:82.42。H,5.38。实测值:C,82.37; H,5.55。
使用危险化学品
有机合成中的程序仅供经过实验有机化学培训的人员使用。所有危险材料应使用参考文献中描述的化学品工作的标准程序进行处理,例如“实验室中的谨慎实践”(美国国家科学院出版社,华盛顿特区,2011年;全文可在http:http:http :. //www.nap.edu/catalog.php?record_id=12654)。所有化学废物应按照当地法规进行处理。有关化学废物管理的一般准则,请参阅“审慎做法”第8章。
在有机合成的一些文章中,化学特定的危害在程序中以红色“注意事项”突出显示。重要的是要认识到没有警告说明并不意味着该程序中涉及的化学品没有重大危害。在进行反应之前,应进行彻底的风险评估,包括审查与该程序计划的规模相关的每种化学品和实验操作的潜在危害。有关进行风险评估和分析化学品相关危害的指南,请参阅“审慎做法”第4章。
有机合成中描述的程序以公布的方式提供,并且风险自负。Organic Syntheses,Inc。,其编辑及其董事会不保证或担保使用这些程序的个人的安全,因此对因本文程序产生或与之相关的任何伤害或损害不承担任何责任。 。
3.讨论
芳基卤化物及其等价物与芳基硼酸的Suzuki-Miyaura偶联现在被认为是形成芳基 – 芳基键的最有效方法之一,其在从药物到高级有机材料的许多有机化学领域中普遍存在。2如果在Suzuki-Miyaura反应中苯酚类亲电子试剂可用作芳基卤化物的替代品,它将显着拓宽该方法的实用性,因为酚类是天然丰富的化学原料,利用独特的优势可以轻松获得各种衍生物。苯酚的反应性特征,例如S E.Ar反应。酚类的交叉偶联可以通过它们转化成三氟甲磺酸芳基酯来经典地实现,从而活化C(芳基)-O键以向金属催化剂的氧化加成。然而,使用基于氟的离去基团引起了成本和浪费的问题,需要开发允许使用较便宜的苯酚衍生物的新催化方法。在这种情况下,甲氧基芳烃将是更理想的偶联剂,因为它们易于获得且无卤素。然而,甲氧基芳烃衍生物的C(芳基)-O键比芳基三氟甲磺酸酯的C(芳基)-O键强得多,因此芳环上的甲氧基可被视为交叉偶联反应中的非无害,非反应性官能团。有趣的是,Wenkert在一项开创性的研究中,3然而,镍络合物的这些有趣的催化性能未能引起足够的重视多年。在过去的十年中,镍催化交叉偶联反应性较低但较常见的苯酚衍生物,如芳基酯,氨基甲酸酯和醚类,取得了巨大进步。4
2008年,我们小组报告了在化学计量的CsF存在下使用Ni(cod)2 / PCy 3作为催化剂的简单甲氧基芳烃的第一次Suzuki-Miyaura反应。5连接到稠合芳族系统(表1,条目1和2)是甲氧基被有效地与苯基代替。使用硼酸酯代替格氏试剂作为亲核偶联伴侣的优点通过官能团(如酮和酯)的耐受性得到证实(表1,条目3和5)。缺电子(表1,条目4和5)和富集(表1,条目6)硼酸酯均以良好的产率提供偶联产物。对空间要求很高的硼酸酯也成功使用(表1,条目7和8)。
我们随后开发了由Ni(cod)2 / ICy(1,3-二环己基咪唑-2-亚基)组成的第二代催化剂,其表现出更广泛的芳基醚底物。6该方法也适用于苄基甲基醚。还报道了关于该反应的机理研究。7虽然Ni(cod)2 / ICy系统比Ni(cod)2 / PCy 3系统更活跃,但Ni(cod)2 / ICy系统对污染氧气和水分更敏感。
由于甲氧基能够耐受有机合成中使用的大多数常见条件,包括使用丁基锂,因此我们的方法允许甲氧基作为后期官能化的可行手段。
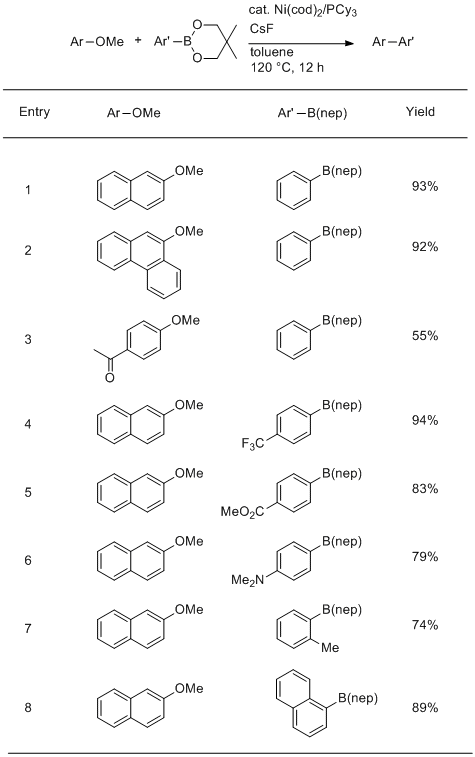
表1. 甲氧基芳烃与芳基硼酸酯的 Ni / PCy 3催化的交叉偶联

反应条件:密封管中的芳基甲基醚(0.5mmol),硼酸酯 (0.75mmol),Ni(cod)2(0.05mmol),PCy 3(0.20mmol),CsF(2.25mmol),甲苯(1.5mL) 。b所有产量均为分离产率。使用c [Ni(cod)2 ](0.10mmol)和PCy 3(0.40mmol)。







